12.05.2016
Постановление
Кабинета Министров Республики Узбекистан
Об утверждении положений о порядке прохождения разрешительных процедур в системе санитарно-эпидемиологической службы Республики Узбекистан
(Собрание законодательства Республики Узбекистан, 2016 г., № 18, ст. 192)
В соответствии с Законами Республики Узбекистан «О санитарно-эпидемиологическом благополучии населения» и «О разрешительных процедурах в сфере предпринимательской деятельности», а также в целях усиления мер по упорядочению и упрощению выдачи документов разрешительного характера в системе санитарно-эпидемиологической службы Республики Узбекистан Кабинет Министров постановляет:
1. Утвердить:
Положение о порядке выдачи разрешения на ввоз и производство новых специально вводимых биологически активных веществ согласно приложению № 1;
Положение о порядке выдачи разрешения на ввоз и производство новых пищевых добавок согласно приложению № 2;
Положение о порядке выдачи разрешения на ввоз и производство новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции согласно приложению № 3.
2. Внести изменения в Перечень документов разрешительного характера в сфере предпринимательской деятельности, утвержденный постановлением Кабинета Министров от 15 августа 2013 г. № 225 (СП Республики Узбекистан, 2013 г., № 8, ст. 55), согласно приложению № 4.
3. Министерству здравоохранения Республики Узбекистан совместно с заинтересованными министерствами и ведомствами:
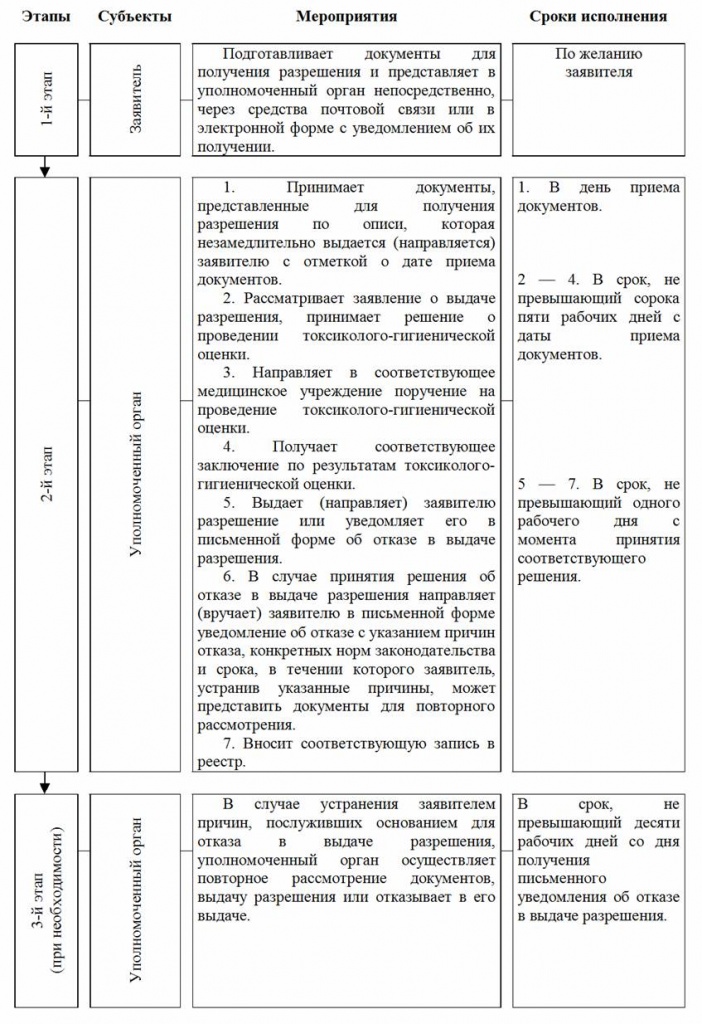
в месячный срок привести свои ведомственные нормативно-правовые акты в соответствие с настоящим постановлением;
обеспечить организацию и проведение мероприятий по широкому освещению целей, содержания и практической значимости настоящего постановления среди субъектов предпринимательства.
4. Контроль за исполнением настоящего постановления возложить на заместителя Премьер-министра Республики Узбекистана А.И. Икрамова.
Премьер-министр Республики Узбекистан Ш. МИРЗИЁЕВ
г. Ташкент,
30 апреля 2016 г.,
№ 131
ПРИЛОЖЕНИЕ № 1
к постановлению Кабинета Министров от 30 апреля 2016 года № 131
ПОЛОЖЕНИЕ
о порядке выдачи разрешения на ввоз и производство новых специально вводимых биологически активных веществ
I. Общие положения
1. Настоящее Положение определяет порядок выдачи разрешения на ввоз и производство новых специально вводимых биологически активных веществ, являющиеся биологически активными добавками к пище (далее — БАД к пище), впервые ввезенные и ранее не производившиеся в Республике Узбекистан.
2. БАД к пище представляют собой концентраты, полученные при переработке продовольственного сырья или искусственным способом и предназначенные для непосредственного приема с пищей или введения в состав пищевых продуктов.
3. Выдача разрешения на ввоз и производство БАД к пище осуществляется по схеме согласно приложению № 1 к настоящему Положению.
4. Разрешение на ввоз и (или) производство БАД к пище (далее — разрешение) выдается Министерством здравоохранения Республики Узбекистан (далее — уполномоченный орган) по форме согласно приложению № 2 к настоящему Положению.
5. Ввоз и производство БАД к пище осуществляется при наличии разрешения, выданного в соответствии с настоящим Положением.
6. Ввоз и производство БАД к пище могут осуществлять юридические и физические лица (далее — заявитель).
7. Ввоз и производство БАД к пище допускается только после проведения токсиколого-гигиенической оценки, проводимой за счет средств заявителя.
8. Разрешение выдается на производителя сроком на 5 лет.
II. Разрешительные требования и условия
9. К разрешительным требованиям и условиям при ввозе и производстве БАД к пище относятся:
обязательное соблюдение заявителем законодательства при ввозе и производстве БАД к пище;
уведомление уполномоченного органа в течение семи рабочих дней после прохождения перерегистрации об изменении наименования или места нахождения (почтового адреса) заявителя;
обязательное соблюдение нормативных документов в области технического регулирования в сфере ввоза и производства БАД к пище;
совершение действия и (или) осуществление определенной деятельности в пределах, указанных в разрешении.
III. Документы и образцы, необходимые для получения разрешения
10. Для получения разрешения в уполномоченный орган представляются следующие документы и образцы:
а) заявление о выдаче разрешения по форме согласно приложению № 3 к настоящему Положению;
б) доверенность от предприятия-производителя на должностное лицо (заявителя), уполномоченное для подачи документов и получения разрешения на имя производителя (в случае, если заявитель не является производителем);
в) образцы БАД к пище в количестве, необходимом для проведения токсиколого-гигиенической оценки;
г) образец потребительской упаковки (тары) БАД к пище или ее проект на государственном и русском языках;
д) документ о полном ингредиентном составе БАД к пище с указанием рекомендаций по применению и противопоказаний;
е) материалы по оценке эффективности заявляемых свойств БАД к пище с указанием организации, проводившей эти исследования;
ж) для БАД к пище, производимых в Республике Узбекистан, дополнительно представляется нормативная документация (стандарты организации, технологическая инструкция и рецептура);
з) для ввозимых БАД к пище дополнительно представляется сертификат безопасности или регистрационное удостоверение страны-производителя (при их наличии);
и) при содержании в БАД к пище частей растений (указывается их ботаническое название, в том числе на латинском языке) дополнительно представляются фармакопейные статьи и (или) государственные стандарты (при их наличии).
11. Требование представления документов, не предусмотренных пунктом 10 настоящего Положения, не допускается.
12. Документы, необходимые для получения разрешения, представляются заявителем в уполномоченный орган непосредственно, через средства почтовой связи или в электронной форме с уведомлением об их получении. Документы, представленные в электронной форме, подтверждаются электронной цифровой подписью заявителя.
При этом образцы представляются непосредственно или через средства почтовой связи.
13. Документы, представленные в уполномоченный орган для получения разрешения, принимаются по описи, которая незамедлительно выдается (направляется) заявителю с отметкой о дате приема документов уполномоченным органом.
14. В случае, когда для выдачи заявителю разрешения требуется получение документов и информации, имеющихся в других государственных органах, запрос осуществляется в упрощенном порядке в «одно окно», при котором уполномоченный орган получает указанные документы самостоятельно без участия заявителя.
IV. Рассмотрение заявления и принятие решения о выдаче или об отказе в выдаче разрешения
15. Уполномоченный орган рассматривает заявление заявителя, выдает или отказывает в выдаче разрешения в срок, не превышающий сорока пяти рабочих дней с даты приема заявления, включая сроки проведения токсиколого-гигиенической оценки.
За рассмотрение заявления о выдаче разрешения сбор не взимается.
16. Уполномоченный орган направляет в соответствующее медицинское учреждение поручение на проведение токсиколого-гигиенической оценки.
Токсиколого-гигиеническая оценка проводится за счет средств заявителя.
17. Соответствующее медицинское учреждение после проведения токсиколого-гигиенической оценки направляет заключение по результатам указанной оценки в уполномоченный орган.
18. Уполномоченный орган выдает (направляет) заявителю разрешение или уведомляет заявителя в письменной форме об отказе в выдаче такого разрешения не позднее одного рабочего дня с момента принятия соответствующего решения.
За выдачу разрешения сбор не взимается.
19. В выдаче разрешения может быть отказано по следующим основаниям:
представление заявителем документов, необходимых для выдачи разрешения не в полном объеме;
несоответствие заявителя разрешительным требованиям и условиям;
наличие в представленных документах недостоверных или искаженных сведений;
обоснованное отрицательное заключение по результатам токсиколого-гигиенической оценки.
Отказ в выдаче разрешения по иным основаниям, в том числе по мотивам нецелесообразности, не допускается.
20. В случае принятия решения об отказе в выдаче разрешения, уведомление об отказе направляется (вручается) заявителю в письменной форме с указанием причин отказа, конкретных норм законодательства и срока, в течение которого заявитель, устранив указанные причины, может представить документы для повторного рассмотрения.
Срок, в течение которого заявитель вправе устранить причины отказа и представить документы для повторного рассмотрения, не может быть менее десяти рабочих дней со дня получения письменного уведомления об отказе в выдаче разрешения.
За повторное рассмотрение заявления заявителя сбор не взимается.
21. Заявление, поданное заявителем по истечении срока, указанного в письменном уведомлении об отказе в выдаче разрешения считается вновь поданным и рассматривается уполномоченным органом на общих основаниях.
22. При повторном рассмотрении документов не допускается приведение со стороны уполномоченного органа причин отказа, ранее не изложенных в письменной форме заявителю, за исключением приведения причин отказа, связанных с документами, удостоверяющими устранение ранее указанных причин.
23. Заявитель имеет право обжаловать в установленном порядке отказ в выдаче разрешения, а также действия (бездействие) должностного лица уполномоченного органа.
V. Переоформление разрешения, продление срока его действия и выдача дубликатов
24. В случае преобразования заявителя-юридического лица, изменения его наименования или местонахождения (почтового адреса) заявитель либо его правопреемник обязан в течение семи рабочих дней после прохождения перерегистрации подать в уполномоченный орган заявление о переоформлении разрешения с приложением документов, подтверждающих указанные сведения.
25. В случае изменения фамилии, имени, отчества или места деятельности заявителя-физического лица, указанного в выданном ему свидетельстве о государственной регистрации, заявитель обязан в течение семи рабочих дней после прохождения перерегистрации подать в уполномоченный орган заявление о переоформлении разрешения с приложением документов, подтверждающих указанные сведения.
26. Документы представляются заявителем в уполномоченный орган непосредственно, через средства почтовой связи или в электронной форме с уведомлением об их получении. Документы, представленные в электронной форме, подтверждаются электронной цифровой подписью заявителя.
27. При переоформлении разрешения требование от заявителя представления документов, не предусмотренных пунктами 24 и 25 настоящего Положения, не допускается.
28. До переоформления разрешения заявитель или его правопреемник, подавший заявление о переоформлении разрешения, совершает или осуществляет указанные в нем действие и (или) деятельность на основании поданного заявления о переоформлении разрешения, с отметкой уполномоченного органа о дате приема заявления.
29. При переоформлении разрешения уполномоченный орган вносит соответствующие изменения в реестр выданных разрешений. Переоформление и выдача разрешения осуществляются в срок не более пяти рабочих дней со дня получения уполномоченным органом заявления о переоформлении разрешения с приложением соответствующих документов.
30. По истечении срока действия разрешения, оно может быть продлено по заявлению заявителя. Заявление о продлении срока действия разрешения должно быть подано в уполномоченный орган до истечения срока действия разрешения. Продление срока действия разрешения осуществляется в порядке, предусмотренном для выдачи разрешения.
31. В случае утраты или порчи разрешения по заявлению заявителя выдается его дубликат.
32. Уполномоченный орган обязан выдать (направить) дубликат разрешения в срок не более пяти рабочих дней со дня получения заявления, а также оригинала разрешения в случае его порчи.
33. За рассмотрение заявления по переоформлению разрешения, продлению срока его действия, выдачу дубликатов документа сборы не взимаются.
VI. Приостановление, прекращение действия или аннулирование разрешения
34. Приостановление (возобновление), прекращение действия или аннулирование разрешения производится в случаях и в порядке, предусмотренных в статьях 22, 23 и 25 Закона Республики Узбекистан «О разрешительных процедурах в сфере предпринимательской деятельности».
35. К грубому нарушению разрешительных требований и условий, дающему основание для прекращения в установленном порядке действия разрешения, относится причинение в результате применения БАД к пище, на которые выдано разрешение, вреда жизни и здоровью граждан, либо создание реальной угрозы причинения такого вреда.
VII. Реестр выданных разрешений
36. Уполномоченный орган ведет реестр выданных разрешений и размещает их на веб-сайте Министерства здравоохранения Республики Узбекистан.
В реестре выданных разрешений указываются следующие основные сведения:
о заявителях (наименование заявителя-юридических лиц, их организационно-правовая форма, почтовый адрес, телефон; фамилия, имя, отчество заявителя-физических лиц, их паспортные данные, почтовый адрес, телефон);
дата выдачи и номер разрешения;
сроки действия разрешений;
наименования БАД к пище и форма их выпуска;
основания и даты переоформления, продления срока действия, приостановления и возобновления действия разрешения;
основания и дата прекращения действия разрешения;
основания и дата аннулирования разрешения;
основания и дата выдачи дубликатов разрешения.
37. Информация, содержащаяся в реестрах выданных разрешений, является открытой для ознакомления.
VIII. Заключительное положение
Лица, виновные в нарушении требований настоящего Положения, несут ответственность в установленном законодательством порядке.
ПРИЛОЖЕНИЕ № 1
к Положению о порядке выдачи разрешения на ввоз и производство новых специально вводимых биологически активных веществ
СХЕМА
выдачи разрешения на ввоз и (или) производство БАД к пище
ПРИЛОЖЕНИЕ № 2 к Положению о порядке выдачи разрешения на ввоз и производство новых специально вводимых биологически активных веществ
|
(Изображение Государственного герба Республики Узбекистан)
|
|
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ
|
|
РЕСПУБЛИКИ УЗБЕКИСТАН
|
|
РАЗРЕШЕНИЕ
|
|
на ввоз (производство) новых БАД к пище
|
|
№________________
|
|
(порядковый номер разрешения)
|
|
Выдано на__________________________________________________________________
|
|
(полное наименование производителя)
|
|
Местонахождение (почтовый адрес ) производителя___________________________
|
|
____________________________________________________________________
|
|
На основании заключения экспертизы представленных документов______________
|
|
____________________________________________________________________
|
|
(данные эксперта)
|
|
от ______ ______20_____г. № ___________;
| | | | | |
|
и заключения по токсиколого-гигиенической оценки, проведенной
| | | |
|
____________________________________________________________________
|
|
(данные учреждения)
|
|
от ______ _______20___ г. № ____________
| | | | | |
|
разрешается________________БАД к пище сроком на 5 лет:
| | | |
| |
(ввоз или производство)
| | | | | | |
|
№
|
Наименование продукции
|
Форма выпуска
|
| | | |
| | | |
| | | |
|
Дата выдачи разрешения: «_____» ____________ 20____г.
| | | |
|
Главный государственный санитарный врач
| | | | | |
|
Республики Узбекистан
|
__________________
|
________________________
|
| | | | |
(подпись)
|
(Ф.И.О.)
|
| | | | | | | | | | | |
|
М.П.
| | | | | | | | | |
ПРИЛОЖЕНИЕ № 3
к Положению о порядке выдачи разрешения на ввоз и производство новых специально вводимых биологически активных веществ
| | | | | |
Министерство здравоохранения
|
| | | | | |
Республики Узбекистан
|
| | | | | |
от_______________________________
|
| | | | | |
_________________________________
|
| | | | | |
(наименование юридического лица, местонахождение (почтовый адрес) и организационно-правовая форма; для частного предпринимателя — фамилия, имя, отчество, с указанием данных документа, удостоверяющего личность гражданина)
|
|
Заявление на выдачу разрешения
|
|
Прошу Вас выдать разрешение на ____________________________________________новой(-ых) БАД к пище,
|
| | | |
(ввоз или производство)
| | |
|
выпускаемой(-ых) под названием(-ями):
| | | | | | |
|
1.___________________________________________________________________
|
|
2.___________________________________________________________________
|
|
3.___________________________________________________________________
|
|
К заявлению прилагаются следующие документы и образцы БАД к пище:
|
|
____________________________________________________________________
|
|
____________________________________________________________________
|
|
____________________________________________________________________
|
|
____________________________________________________________________
|
|
____________________________________________________________________
|
|
Ф.И.О. подпись заявителя,
| | | | | | |
|
20_____ год _______ ____________________
| | | | |
| | | | | | | | | | |
|
(М.П.)
| | | | | | | | |
Примечание. В заявлении указываются все наименования представляемых БАД к пище и их формы выпуска.
ПРИЛОЖЕНИЕ № 2
к постановлению Кабинета Министров от 30 апреля 2016 года № 131
ПОЛОЖЕНИЕ
о порядке выдачи разрешения на ввоз и производство новых пищевых добавок
I. Общие положения
1. Настоящее Положение определяет порядок выдачи разрешения на ввоз и производство новых пищевых добавок (далее — пищевые добавки), впервые ввезенных и ранее не производившихся в Республике Узбекистан.
2. Пищевые добавки представляют собой природные или синтезированные вещества, соединения, преднамеренно вводимые в пищевые продукты с целью придания им заданных свойств и (или) их сохранения.
3. Выдача разрешения на ввоз и производство пищевых добавок осуществляется по схеме согласно приложению № 1 к настоящему Положению.
4. Разрешение на ввоз и (или) производство пищевых добавок (далее — разрешение) выдается Министерством здравоохранения Республики Узбекистан (далее — уполномоченный орган) по форме согласно приложению № 2 к настоящему Положению.
5. Ввоз и производство пищевых добавок осуществляется при наличии разрешения, выданного в соответствии с настоящим Положением.
6. Ввоз и производство пищевых добавок могут осуществлять юридические и физические лица (далее — заявитель).
7. Ввоз и производство пищевых добавок допускается только после проведения токсиколого-гигиенической оценки, проводимой за счет средств заявителя.
8. Разрешение выдается на неограниченный срок.
II. Разрешительные требования и условия
9. К разрешительным требованиям и условиям при ввозе и производстве пищевых добавок относятся:
обязательное соблюдение заявителем законодательства при ввозе и производстве пищевых добавок;
уведомление уполномоченного органа в течение семи рабочих дней после прохождения перерегистрации об изменении наименования или места нахождения (почтового адреса) заявителя;
обязательное соблюдение нормативных документов в области технического регулирования в сфере ввоза и производства пищевых добавок;
совершение действия и (или) осуществление определенной деятельности в пределах, указанных в разрешении.
III. Документы и образцы, необходимые для получения разрешения
10. Для получения разрешения в уполномоченный орган представляются следующие документы и образцы:
а) заявление о выдаче разрешения по форме согласно приложению № 3 к настоящему Положению;
б) спецификация (характеристика) пищевой добавки с указанием состава, назначения и дозы применения;
в) образцы пищевых добавок в количестве, необходимом для проведения токсиколого-гигиенической оценки;
г) для ввозимых пищевых добавок дополнительно представляется сертификат безопасности или регистрационное удостоверение страны-производителя (при их наличии);
д) для пищевых добавок, производимых в Республике Узбекистан, дополнительно представляется нормативная документация (стандарты организации, технологическая инструкция и рецептура).
11. Требования по представлению документов, не предусмотренных пунктом 10 настоящего Положения, не допускаются.
12. Документы, необходимые для получения разрешения, предоставляются заявителем в уполномоченный орган, непосредственно, через средства почтовой связи или в электронной форме с уведомлением об их получении. Документы, представленные в электронной форме, подтверждаются электронной цифровой подписью заявителя.
При этом образцы представляются непосредственно или через средства почтовой связи.
13. Документы, представленные в уполномоченный орган для получения разрешения, принимаются по описи, которая незамедлительно выдается (направляется) заявителю с отметкой о дате приема документов уполномоченным органом.
14. В случае, когда для выдачи заявителю разрешения требуется получение документов и информация, имеющихся в других государственных органах, запрос осуществляется в упрощенном порядке в «одно окно», при котором уполномоченный орган получает указанные документы самостоятельно без участия заявителя.
IV. Рассмотрение заявления и принятие решения о выдаче или об отказе в выдаче разрешения
15. Уполномоченный орган рассматривает заявление заявителя, выдает или отказывает в выдаче разрешения в срок, не превышающий сорока пяти рабочих дней с даты приема заявления, включая сроки проведения токсиколого-гигиенической оценки.
За рассмотрение заявления о выдаче разрешения сбор не взимается.
16. Уполномоченный орган направляет в соответствующее медицинское учреждение поручение на проведение токсиколого-гигиенической оценки.
Токсиколого-гигиеническая оценка проводится за счет средств заявителя.
17. Соответствующее медицинское учреждение после проведения токсиколого-гигиенической оценки направляет заключение по результатам указанной оценки в уполномоченный орган.
18. Уполномоченный орган выдает (направляет) заявителю разрешение или уведомляет заявителя в письменной форме об отказе в выдаче такого разрешения не позднее одного рабочего дня с момента принятия соответствующего решения.
За выдачу разрешения сбор не взимается.
19. В выдаче разрешения может быть отказано по следующим основаниям:
представление заявителем документов, необходимых для выдачи разрешения не в полном объеме;
несоответствие заявителя разрешительным требованиям и условиям;
наличие в представленных документах недостоверных или искаженных сведений;
обоснованное отрицательное заключение по результатам токсиколого-гигиенической оценки.
Отказ в выдаче разрешения по иным основаниям, в том числе по мотивам нецелесообразности, не допускается.
20. В случае принятия решения об отказе в выдаче разрешения, уведомление об отказе направляется (вручается) заявителю в письменной форме с указанием причин отказа, конкретных норм законодательства и срока, в течение которого заявитель, устранив указанные причины, может представить документы для повторного рассмотрения.
Срок, в течение которого заявитель вправе устранить причины отказа и представить документы для повторного рассмотрения, не может быть менее десяти рабочих дней со дня получения письменного уведомления об отказе в выдаче разрешения.
За повторное рассмотрение заявления сбор не взимается.
21. Заявление, поданное заявителем по истечении срока, указанного в письменном уведомлении об отказе в выдаче разрешения считается вновь поданным и рассматривается уполномоченным органом на общих основаниях.
22. При повторном рассмотрении документов не допускается приведение со стороны уполномоченного органа причин отказа, ранее не изложенных в письменной форме заявителю, за исключением приведения причин отказа, связанных с документами, удостоверяющими устранение ранее указанных причин.
23. Заявитель имеет право обжаловать в установленном порядке отказ в выдаче разрешения, а также действия (бездействие) должностного лица уполномоченного органа.
V. Переоформление разрешения и выдача дубликатов
24. В случае преобразования заявителя-юридического лица, изменения его наименования или местонахождения (почтового адреса) заявитель либо его правопреемник обязан в течение семи рабочих дней после прохождения перерегистрации подать в уполномоченный орган заявление о переоформлении разрешения с приложением документов, подтверждающих указанные сведения.
25. В случае изменения фамилии, имени, отчества или места деятельности заявителя-физического лица, указанного в выданном ему свидетельстве о государственной регистрации, заявитель обязан в течение семи рабочих дней после прохождения перерегистрации подать в уполномоченный орган заявление о переоформлении разрешения с приложением документов, подтверждающих указанные сведения.
26. Документы представляются заявителем в уполномоченный орган непосредственно, через средства почтовой связи или в электронной форме с уведомлением об их получении. Документы, представленные в электронной форме, подтверждаются электронной цифровой подписью заявителя.
27. При переоформлении разрешения требование от заявителя представления документов, не предусмотренных пунктами 24 и 25 настоящего Положения, не допускается.
28. До переоформления разрешения заявитель или его правопреемник, подавший заявление о переоформлении разрешения, совершает или осуществляет указанные в нем действие и (или) деятельность на основании поданного заявления о переоформлении разрешения, с отметкой уполномоченного органа о дате приема заявления.
29. При переоформлении разрешения уполномоченный орган вносит соответствующие изменения в реестр выданных заключений. Переоформление и выдача разрешения осуществляются в срок не более пяти рабочих дней со дня получения уполномоченным органом заявления о переоформлении разрешения с приложением соответствующих документов.
30. В случае утраты или порчи разрешения по заявлению заявителя выдается его дубликат.
Уполномоченный орган обязан выдать (направить) дубликат разрешения в срок не более пяти рабочих дней со дня получения заявления, а также оригинала разрешения в случае его порчи.
31. За рассмотрение заявления по переоформлению разрешения, выдачу дубликатов документа сборы не взимаются.
VI. Приостановление, прекращение действия и аннулирование разрешения
32. Приостановление (возобновление), прекращение действия или аннулирование разрешения производится в случаях и в порядке, предусмотренных в статьях 22, 23 и 25 Закона Республики Узбекистан «О разрешительных процедурах в сфере предпринимательской деятельности».
33. К грубому нарушению разрешительных требований и условий, дающему основание для прекращения в установленном порядке действия разрешения, относится причинение в результате применения пищевых добавок, на которые выдано разрешение, вреда жизни и здоровью граждан либо создание реальной угрозы причинения такого вреда.
VII. Реестр выданных разрешений
34. Уполномоченный орган ведет реестр выданных разрешений и размещает их на официальном веб-сайте Министерства здравоохранения Республики Узбекистан.
В реестре выданных разрешений должны быть указаны следующие основные сведения:
о заявителях (наименование заявителя-юридических лиц, их организационно-правовая форма, почтовый адрес, телефон; фамилия, имя, отчество заявителя- физических лиц, их паспортные данные, почтовый адрес, телефон);
дата выдачи и номер разрешения;
наименование пищевой добавки;
назначение и дозы применения пищевой добавки;
основания и даты переоформления, приостановления и возобновления действия разрешения;
основания и дата прекращения действия разрешения;
основания и дата аннулирования разрешения;
основания и дата выдачи дубликатов разрешения.
35. Информация, содержащаяся в реестрах выданных разрешений, является открытой для ознакомления.
VIII. Заключительное положение
Лица, виновные в нарушении требований настоящего Положения, несут ответственность в установленном законодательством порядке.
ПРИЛОЖЕНИЕ № 1
к Положению о порядке выдачи разрешения на ввоз и производство новых пищевых добавок
СХЕМА
выдачи разрешения на ввоз и производство новых пищевых добавок

ПРИЛОЖЕНИЕ № 2 к Положению о порядке выдачи разрешения на ввоз и производство новых пищевых добавок
|
(Изображение Государственного герба Республики Узбекистан)
|
|
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ
|
|
РЕСПУБЛИКИ УЗБЕКИСТАН
|
|
РАЗРЕШЕНИЕ
|
|
на ввоз (производство) новых пищевых добавок
|
|
№_______
|
|
(порядковый номер разрешения)
|
|
Выдано на____________________________________________________________
|
|
(наименование заявителя — юридического лица; фамилия, имя, отчество заявителя — физического лица )
|
|
Местонахождение (почтовый адрес) заявителя _______________________________
|
|
____________________________________________________________________
|
|
На основании заключения экспертизы представленных документов
|
|
____________________________________________________________________
|
|
(данные эксперта)
|
|
от _____ _________20___г. № _____;
| | | | | | |
|
и заключения по токсиколого-гигиенической оценки, проведенной
|
|
____________________________________________________________________
|
|
(данные учреждения)
|
|
от ______ ________20_____г. № _____________
| | | | |
|
разрешается _______________________ новых пищевых добавок:
| | |
| |
(ввоз или производство)
| | | | | | |
|
№
|
Наименование продукции
|
Производитель
|
Назначение
|
Доза применения
|
| | | | | |
| | | | | |
|
Дата выдачи разрешения _________ __________ 20_____г.
| | | |
|
Главный государственный санитарный врач
| | | | | | |
|
Республики Узбекистан
|
_________________
|
_____________________________
|
| | | |
(подпись)
|
(Ф.И.О.)
|
|
М.П.
| | | | | | | | | |
| | | | | | | | | | | |
ПРИЛОЖЕНИЕ № 3
к Положению о порядке выдачи разрешения на ввоз и производство новых пищевых добавок
| | | | | |
Министерство здравоохранения
|
| | | | | |
Республики Узбекистан
|
| | | | | |
от________________________________
|
| | | | | |
_________________________________
|
| | | | | |
(наименование юридического лица, местонахождение (почтовый адрес) и организационно-правовая форма; для частного предпринимателя — фамилия, имя, отчество, с указанием данных документа, удостоверяющего личность гражданина)
|
|
Заявление на выдачу разрешения
|
|
Прошу Вас выдать разрешение на _____________________новой(-ых) пищевой(-ых)
|
|
(ввоз или производство)
|
|
добавки(-ок), выпускаемой(-ых) под названием(-ями):
| | | |
|
1.___________________________________________________________________
|
|
2.___________________________________________________________________
|
|
3.___________________________________________________________________
|
|
К заявлению прилагаются следующие документы и образцы пищевых добавок:
|
|
____________________________________________________________________
|
|
____________________________________________________________________
|
|
____________________________________________________________________
|
|
____________________________________________________________________
|
|
____________________________________________________________________
|
|
Ф.И.О. подпись заявителя,
| | | | | | |
|
20_____ год _______ ________________
| | | | | |
| | | | | | | | | | |
|
(М.П.)
| | | | | | | | |
Примечание: в заявлении указываются все наименования представляемых пищевых добавок.
ПРИЛОЖЕНИЕ № 3
к постановлению Кабинета Министров от 30 апреля 2016 года № 131
ПОЛОЖЕНИЕ
о порядке выдачи разрешения на ввоз и производство новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции
I. Общие положения
1. Настоящее Положение определяет порядок выдачи разрешения на ввоз и производство новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции, впервые ввезенных и ранее не производившихся в Республике Узбекистан.
2. Выдача разрешения на ввоз и производство новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции осуществляется по схеме согласно приложению № 1 к настоящему Положению.
3. Разрешение на ввоз и (или) производство новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции (далее — разрешение) выдается Министерством здравоохранения Республики Узбекистан (далее — уполномоченный орган) по форме согласно приложению № 2 к настоящему Положению.
4. Ввоз и производство новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции осуществляется при наличии разрешения, выданного в соответствии с настоящим Положением.
5. Ввоз и производство новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции могут осуществлять юридические и физические лица (далее — заявитель).
6. Ввоз и производство новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции допускается только после проведения токсиколого-гигиенической оценки, проводимой за счет средств заявителя.
7. Разрешение выдается на неограниченный срок.
II. Разрешительные требования и условия
8. К разрешительным требованиям и условиям при ввозе и производстве новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции относятся:
обязательное соблюдение заявителем законодательства при ввозе и производстве новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции;
уведомление уполномоченного органа в течение семи рабочих дней после прохождения перерегистрации об изменении наименования или места нахождения (почтового адреса) заявителя;
обязательное соблюдение нормативных документов в области технического регулирования в сфере ввоза и производства новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции;
совершение действия и (или) осуществление определенной деятельности в пределах, указанных в разрешении.
III. Документы и образцы, необходимые для получения разрешения
9. Для получения разрешения в уполномоченный орган представляются следующие документы и образцы:
а) заявление о выдаче разрешения по форме согласно приложению № 3 к настоящему Положению;
б) образцы новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции в количестве, необходимом для проведения токсиколого-гигиенической оценки;
в) образец потребительской упаковки (тара) или ее проект на государственном и русском языках (при наличии);
г) пояснительная записка (инструкция по применению), содержащая характеристику химических и физико-химических свойств новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции;
д) для новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции, производимых в республике, дополнительно представляется нормативная документация (стандарты, технологическая инструкция);
е) для ввозимых новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции дополнительно представляется документ страны-производителя, подтверждающий безопасность ввозимых новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции (при наличии).
10. Требование представления документов, не предусмотренных пунктом 9 настоящего Положения, не допускается.
11. Документы, необходимые для получения разрешения, представляются заявителем в уполномоченный орган непосредственно через средства почтовой связи или в электронной форме с уведомлением об их получении. Документы, представленные в электронной форме, подтверждаются электронной цифровой подписью заявителя.
12. Документы, представленные в уполномоченный орган для получения разрешения, принимаются по описи, которая незамедлительно выдается (направляется) заявителю с отметкой о дате приема документов уполномоченным органом.
13. В случае, когда для выдачи заявителю разрешения требуется получение документов и информации, имеющихся в других государственных органах, запрос осуществляется в упрощенном порядке в «одно окно», при котором уполномоченный орган получает указанные документы самостоятельно без участия заявителя.
IV. Рассмотрение заявления и принятие решения о выдаче или об отказе в выдаче разрешения
14. Уполномоченный орган рассматривает заявление заявителя, выдает или отказывает в выдаче разрешения в срок, не превышающий ста двадцати рабочих дней с даты приема заявления, включая сроки проведения токсиколого-гигиенической оценки.
За рассмотрение заявления о выдаче разрешения сбор не взимается.
15. Уполномоченный орган направляет в соответствующее медицинское учреждение поручение на проведение токсиколого-гигиенической оценки.
Токсиколого-гигиеническая оценка проводится за счет средств заявителя.
16. Соответствующее медицинское учреждение после проведения токсиколого-гигиенической оценки направляет заключение по результатам указанной оценки в уполномоченный орган.
17. Уполномоченный орган выдает (направляет) заявителю разрешение или уведомляет заявителя в письменной форме об отказе в выдаче такого разрешения не позднее одного рабочего дня с момента принятия соответствующего решения.
За выдачу разрешения сбор не взимается.
18. В выдаче разрешения может быть отказано по следующим основаниям:
представление заявителем документов, необходимых для выдачи разрешения не в полном объеме;
несоответствие заявителя разрешительным требованиям и условиям;
наличие в представленных документах недостоверных или искаженных сведений;
обоснованное отрицательное заключение по итогам токсиколого-гигиенической оценки.
Отказ в выдаче разрешения по иным основаниям, в том числе по мотивам нецелесообразности, не допускается.
19. В случае принятия решения об отказе в выдаче разрешения, уведомление об отказе направляется (вручается) заявителю в письменной форме с указанием причин отказа, конкретных норм законодательства и срока, в течение которого заявитель, устранив указанные причины, может представить документы для повторного рассмотрения.
Срок, в течение которого заявитель вправе устранить причины отказа и представить документы для повторного рассмотрения, не может быть менее десяти рабочих дней со дня получения письменного уведомления об отказе в выдаче разрешения.
За повторное рассмотрение заявления сбор не взимается.
20. Заявление, поданное заявителем по истечении срока, указанного в письменном уведомлении об отказе в выдаче разрешения считается вновь поданным и рассматривается уполномоченным органом на общих основаниях.
21. При повторном рассмотрении документов не допускается приведение со стороны уполномоченного органа причин отказа, ранее не изложенных в письменной форме заявителю, за исключением приведения причин отказа, связанных с документами, удостоверяющими устранение ранее указанных причин.
22. Заявитель имеет право обжаловать в установленном порядке отказ в выдаче разрешения, а также действия (бездействие) должностного лица уполномоченного органа.
V. Переоформление разрешения и выдача дубликатов
23. В случае преобразования заявителя-юридического лица, изменения его наименования или местонахождения (почтового адреса) заявитель либо его правопреемник обязан в течение семи рабочих дней после прохождения перерегистрации подать в уполномоченный орган заявление о переоформлении разрешения с приложением документов, подтверждающих указанные сведения.
24. В случае изменения фамилии, имени, отчества или места деятельности заявителя-физического лица, указанного в выданном ему свидетельстве о государственной регистрации, заявитель обязан в течение семи рабочих дней после прохождения перерегистрации подать в уполномоченный орган заявление о переоформлении разрешения с приложением документов, подтверждающих указанные сведения.
25. Документы представляются заявителем в уполномоченный орган непосредственно, через средства почтовой связи или в электронной форме с уведомлением об их получении. Документы, представленные в электронной форме, подтверждаются электронной цифровой подписью заявителя.
26. При переоформлении разрешения требование от заявителя представления документов, не предусмотренных пунктами 23 и 24 настоящего Положения, не допускается.
27. До переоформления разрешения заявитель или его правопреемник (наследник), подавший заявление о переоформлении разрешения, совершает или осуществляет указанные в нем действие и (или) деятельность на основании поданного заявления о переоформлении разрешения, с отметкой уполномоченного органа о дате приема заявления.
28. При переоформлении разрешения уполномоченный орган вносит соответствующие изменения в реестр выданных разрешений. Переоформление и выдача разрешения осуществляются в срок не более пяти рабочих дней со дня получения уполномоченным органом заявления о переоформлении разрешения с приложением соответствующих документов.
29. В случае утраты или порчи разрешения по заявлению заявителя выдается его дубликат.
Уполномоченный орган обязан выдать (направить) дубликат разрешения в срок не более пяти рабочих дней со дня получения заявления, а также оригинала разрешения в случае его порчи.
30. За рассмотрение заявления по переоформлению разрешения, выдачу дубликатов документа сборы не взимаются.
VI. Приостановление, прекращение действия и аннулирование разрешения
31. Приостановление (возобновление), прекращение действия или аннулирование разрешения производится в случаях и в порядке, предусмотренных в статьях 22, 23 и 25 Закона Республики Узбекистан «О разрешительных процедурах в сфере предпринимательской деятельности».
32. К грубому нарушению разрешительных требований и условий, дающему основание для прекращения в установленном порядке действия разрешения, относится причинение в результате применения новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции, на которые выдано разрешение, вреда жизни и здоровью граждан, либо создание реальной угрозы причинения такого вреда.
VII. Реестр выданных разрешений
33. Уполномоченный орган ведет реестр выданных разрешений и размещает их на веб-сайте Министерства здравоохранения Республики Узбекистан.
В реестре выданных разрешений указываются следующие основные сведения:
о заявителях (наименование заявителя-юридических лиц, их организационно-правовая форма, почтовый адрес, телефон; фамилия, имя, отчество заявителя-физических лиц, их паспортные данные, почтовый адрес, телефон);
даты выдачи и номер разрешения;
наименования новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции;
основания и даты переоформления, приостановления и возобновления действия разрешения;
основания и дата прекращения действия разрешения;
основания и дата аннулирования разрешения;
основания и даты выдачи дубликатов разрешения.
34. Информация, содержащаяся в реестрах выданных разрешений, является открытой для ознакомления.
VIII. Заключительное положение
35. Лица, виновные в нарушении требований настоящего Положения, несут ответственность в установленном законодательством порядке.
ПРИЛОЖЕНИЕ № 1
к Положению о порядке выдачи разрешения на ввоз и производство новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции
СХЕМА
выдачи разрешения на ввоз и производство новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции

ПРИЛОЖЕНИЕ № 2 к Положению о порядке выдачи разрешения на ввоз и производство новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции
|
(Изображение Государственного герба Республики Узбекистан)
|
|
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ
|
|
РЕСПУБЛИКИ УЗБЕКИСТАН
|
|
РАЗРЕШЕНИЕ
|
|
на ввоз (производство) новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции
|
|
№_______
|
|
(порядковый номер разрешения)
|
|
Выдано на____________________________________________________________
|
|
(наименование заявителя — юридического лица; фамилия, имя, отчество заявителя — физического лица )
|
|
Местонахождение (почтовый адрес) заявителя _______________________________
|
|
____________________________________________________________________
|
|
На основании заключения экспертизы представленных документов
|
|
____________________________________________________________________
|
|
(данные эксперта)
|
|
от ______ _______20_____г. № __________;
| | | | | |
|
и заключения по токсиколого-гигиенической оценки, проведенной
|
|
____________________________________________________________________
|
|
(данные учреждения)
|
|
от ______ ________20_____г. № _________
| | | | | |
|
разрешается ________________________________:
| | | | |
| |
(ввоз или производство)
| | | | | |
|
№
|
Наименование
|
Производитель
|
Страна
|
| | | | |
| | | | |
|
Дата выдачи разрешения ________ ___________ 20_____г.
| | | |
|
Главный государственный санитарный врач
| | | | | | |
|
Республики Узбекистан
|
__________________
(подпись)
|
______________________________
(Ф.И.О.)
|
|
М.П.
| | | | | | | | | |
| | | | | | | | | | |
ПРИЛОЖЕНИЕ № 3
к Положению о порядке выдачи разрешения на ввоз и производство новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции
| | | | | |
Министерство здравоохранения
|
| | | | | |
Республики Узбекистан
|
| | | | | |
от________________________________
|
| | | | | |
_________________________________
|
| | | | | |
(наименование юридического лица, местонахождение (почтовый адрес) и организационно-правовая форма; для частного предпринимателя — фамилия, имя, отчество, с указанием данных документа, удостоверяющего личность гражданина)
|
|
Заявление на выдачу разрешения
|
|
Прошу Вас выдать разрешение на ____________________________________новых
|
|
(ввоз или производство)
|
|
____________________________________________________________________
|
|
(химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции)
|
|
1.___________________________________________________________________
|
|
2.___________________________________________________________________
|
|
3.___________________________________________________________________
|
|
К заявлению прилагаются следующие документы и образцы БАД к пище:
|
|
____________________________________________________________________
|
|
____________________________________________________________________
|
|
____________________________________________________________________
|
|
____________________________________________________________________
|
|
____________________________________________________________________
|
|
Ф.И.О. подпись заявителя,
| | | | | | |
|
20_____ год _______ _______________
| | | | | |
| | | | | | | | | | |
|
(М.П.)
| | | | | | | | |
Примечание. В заявлении указываются все наименования представляемых новых химических веществ, биологических средств и материалов, полимерных и пластических масс, парфюмерно-косметической продукции.
ПРИЛОЖЕНИЕ № 4
к постановлению Кабинета Министров от 30 апреля 2016 года № 131
Изменения, вносимые в Перечень документов разрешительного характера в сфере предпринимательской деятельности
1. В позиции 159 графы «Наименование документа разрешительного характера (процедуры)» слово «заключение» заменить словом «разрешение».
2. В позиции 160:
а) в графе «Наименование документа разрешительного характера (процедуры)» слова «применение новых химических веществ, биологических средств, материалов» заменить словами «ввоз и производство новых химических веществ, биологических средств и материалов»;
б) в графе «Действие и (или) определенная деятельность, для совершения и (или) осуществления которых необходим документ разрешительного характера» слова «Применение новых химических веществ, биологических средств, материалов» заменить словами и «Ввоз и производство новых химических веществ, биологических средств и материалов».
Номер документа:
№ 131
Дата принятия:
30.04.2016







