29.12.2007
Приложение № 8
к Приказу Минздрава РУз
№ 600 от 29 декабря 2007 г.
Инструкция по дезинфекции, предстерилизационной очистке и стерилизации медицинского инструментария, шприцев и других медицинских изделий
1 . 1 . Дезинфекция, предстерилизационная очистка и стерилизация изделий медицинского назначения (далее изделия) направлены на профилактику внутрибольничных инфекций у пациентов и персонала лечебно-профилактических учреждений (ЛПУ).
Дезинфекцию изделий проводят с целью уничтожения патогенных и условно-патогенных микроорганизмов - вирусов (в том числе возбудителей парентеральных вирусных гепатитов, ВИЧ-инфекции),бактерий (включая микобактерии туберкулеза, грибов) на изделиях медицинского назначения,а также в их каналах и полостях.
1 . 3 . Стерилизацию проводят с целью умерщвления на изделиях или в изделиях микроорганизмов. Стерилизации подлежат все изделия, соприкасающиеся с раневой поверхностью, контактирующие с кровью в организме пациента или вводимой в него, инъекционными препаратами, а так же изделия, которые в процессе эксплуатации контактируют со слизистой оболочкой и могут вызвать её повреждение.
Дезинфекции подлежат все изделия после применения их у пациента.
1 . 5 . Изделия медицинского назначения многократного применения, которые в процессе эксплуатации могут вызвать повреждение кожи, слизистой оболочки, соприкасаются с раневой поверхностью, контактируют с кровью или инъекционными препаратами, подлежат дезинфекции на месте. После дезинфекции изделия подвергают предстерилизационной очистке.
1 . 6 . Изделия многократного применения, подлежащие стерилизации, перед стерилизацией подвергают предстерилизационной очистке.
1 . 7 . Предстерилизационную очистку проводят с целью удаления с изделий белковых, жировых и механических загрязнений, а также остатков лекарственных препаратов. В качестве средств дезинфекции, предстерилизационной очистки и стерилизации используют только разрешенные в установленном порядке в Республике Узбекистан физические и химические средства.
1 . 9 . При выборе средств следует учитывать рекомендации изготовителей изделий, касающиеся воздействия конкретных средств (из числа разрешенных в нашей стране для данной цели) на материалы этих изделий.
1 . 10 . При проведении дезинфекции, предстерилизационной очистки и стерилизации допускается использование только того оборудования (установки, моечные машины, стерилизаторы и др.), которые разрешены в установленном порядке к промышленному выпуску и применению (в случае импортного оборудования - разрешенного к применению) в Республике Узбекистан.
1 . 11 . Ёмкости с растворами дезинфицирующих, моющих и стерилизующих средств должны быть снабжены крышками, иметь четкие надписи с указанием названия средства, его концентрации, назначения, даты приготовления (для готовых к применению средств, разрешенных для многократного использования, указывают).
1 . 12 . Изделия медицинского назначения, применяемые в стоматологии, отличаются разнообразием по конструкции, по составу входящих в них материалов, по назначению и поэтому требуют тщательного выбора метода и средства дезинфекции.
1 . 13 . Стоматологические изделия, выдерживающие воздействие высоких температур, дезинфицируют кипячением или воздействием сухого горячего воздуха, предстерилизационная очистка проводится так же, как и др. мединструментария.
1 . 14 . Для дезинфекции стоматологических инструментов рекомендованы средства на основе альдегидов, спиртов, катионных ПАВ, содержащих кроме действующих веществ, анионные и неионогенные ПАВ, ингибиторы коррозии и другие компоненты.
По окончании дезинфекционной выдержки изделия промывают проточной питьевой водой.
Дезинфекцию стоматологических оттисков осуществляют после их предварительного промывания водой с соблюдением мер противоэпидемической защиты.
Во время промываний оттисков следует избегать разбрызгивания смывных вод.
1 . 16 . Дезинфекцию оттисков проводят способом погружения в раствор дезинфицирующего средства. Выбор дезинфицирующего средства обусловлен видом оттискного материала. Набор дезинфицирующих средств для обеззараживания оттисков из силиконовых материалов шире, чем для оттисков из альгинатных материалов.
1 . 17 . Режимы дезинфекции оттисков представлены в таблице №5, они обеспечивают их от вирусов (в том числе возбудителей парентеральных вирусных гепатитов, ВИЧ-инфекций), бактерий, грибов рода Кандида.
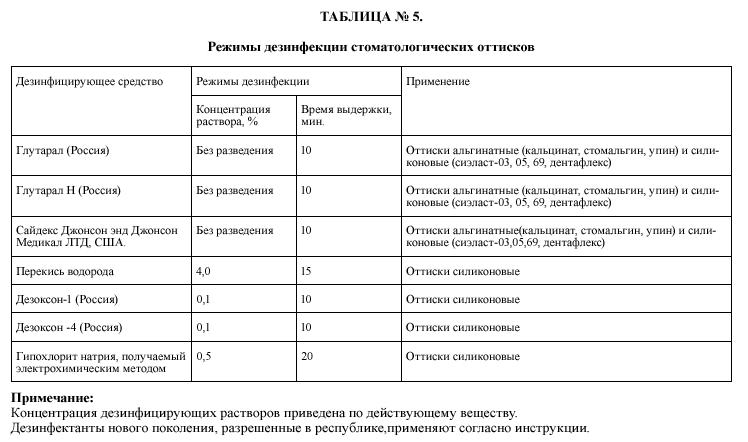
1 . 18 . После дезинфекции оттиски промывают водой для удаления остатков дезинфицирующего средства.
1 . 19 . Рекомендации по дезинфекции, предстерилизационной очистке и стерилизации сложных по конструкции изделий (эндоскопы, медицинские инструменты к гибким эндоскопам и др.), а также дополнительные сведения, касающиеся различных аспектов указанных видов обработки изделий, более подробно изложены в ряде официальных инструктивно-методических документах, по применению их.
1 . 20 . При проведении дезинфекции применяются дезинфекционные средства, разрешенные к применению в Республики Узбекистан.
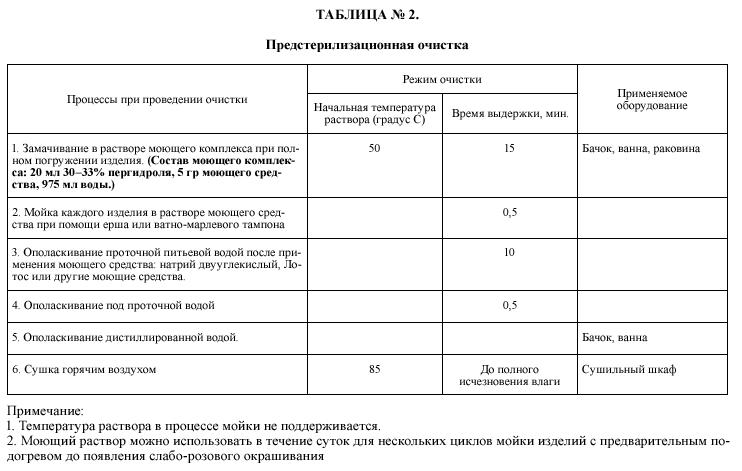
1 . 21 . Предстерилизационная очистка является важным этапом в процессе проведения стерилизации. Запрещается проведение предстерилизационной очистки медицинского инструментария и других медицинских изделий в отделениях стационаров, операционных блоках, перевязочных и т.д. В ОЦС принимается медицинский инструментарий, прошедший обеззараживание в 0,5%хлорсодержащем дезинфектанте с экспозицией не менее 10 мин или в другом дезинфектанте согласно применяемой инструкции.
1 . 22 . Предстерилизационная очистка медицинского инструментария и приравненных к ним изделий, проводятся только в отделениях (пунктах) централизованной стерилизации, согласно таблице № 2.
1 . 23 . Качество предстерилизационной очистки изделий оценивают путем постановки азопирамовой, амидопириновой проб и пробы НИРИ (согласно инструкции)на наличие остаточного количества крови и биологических субстратов организма, а также путем постановки фенолфталеиновой пробы на наличие остаточных количеств щелочных компонентов моющих средств.
1 . 24 . Стерилизация - это процесс уничтожения всех микроорганизмов (бактерии, грибки и паразиты), в том числе бактериальных спор с неживых предметов паром под высоким давлением (автоклав), сухим жаром (сухожаровой шкаф), химическим методом.
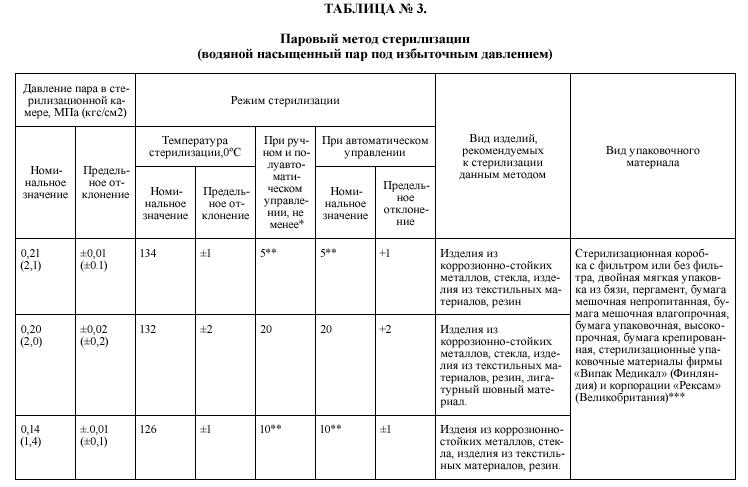
Стерилизацию осуществляют физическими (паровой, воздушный, в среде нагретых шариков) и химическими (применение растворов химических средств, газовый) методами согласно таблицы № 3,4,6,7.




1 . 25 . Хирургическое белье, перевязочный материал укладывают в стерилизационные коробки параллельно движению пара. Запрещается плотно укладывать материал. Норма загрузки стерилизационных коробок хирургическим бельем и перевязочным материалом представлена в таблице № 1.

1 . 26 . Резиновые перчатки перед стерилизацией пересыпают внутри и снаружи тальком для предохранения их от склеивания. Между перчатками прокладывают марлю или бумагу, каждую пару перчаток заворачивают отдельно в марлю или бумагу и в таком виде помещают в стерилизационную коробку или в другую упаковку. В целях уменьшения неблагоприятного воздействия пара резиновые перчатки, как и другие изделия из резин, стерилизуют при температуре 120-122 °С.
1 . 27 . Паровым методом стерилизуют лигатурный шовный материал: нити хирургические шелковые кручёные, нити хирургические капроновые крученые, шнуры хирургические полиэфирные (далее - лигатурный шовный материал).
1 . 28 . Лигатурный шовный материал готовят к стерилизации в виде косичек, мотков, наматывая на катушки, стеклянные палочки и т.д. Подготовленный лигатурный шовный материал заворачивают в два слоя упаковочного материала (при размещении в стерилизационной коробке - в один слой упаковочного материала) в количестве, рассчитанном на одну операцию. Нити хирургические капроновые крученые стерилизуют паром только при температуре 120-122 °С; лигатурный шовный материал других видов допускается стерилизовать, кроме того, при температуре 130-134 °С лигатурный шовный материал хранят в той же упаковке, в которой он был простерилизован, в специальных шкафах для стерильных изделий. Неиспользованный стерильный лигатурный шовный материал в случае нарушения условий или истечения срока хранения может быть повторно (еще лишь один раз) простерилизован паровым методом при температуре 120-122 °С.
1 . 29 . Стерилизация в пароформалиновых камерах допускается после проведения дезинфекции, предстерилизационной очистки и только в камерах заводского изготовления, имеющих соответствующий паспорт и регулирующий концентрацию паров.
Пароформалиновые камеры должны быть установлены в специально предназначенных помещениях при ОЦС и наличии соответствующей вентиляции.
2 . 0 . Контроль параметров режимов стерилизации проводят физическим (с помощью контрольно-измерительных приборов: термометров, мановакуумметров и др.) и химическим с использованием химических индикаторов (ИВС и ИКПВС - Медтест, Стеритест-В, П, Вл-Винар, Медис-В, Фарматест-Винар и другими). Эффективность стерилизации оценивают на основании результатов контроля стерильности изделий, подвергнутых стерилизации, отражают в журнале № 257/У (см. ниже).
Изделия медицинского назначения многократного применения, которые в процессе эксплуатации могут вызвать повреждение кожи, слизистой оболочки, соприкасаются с раневой поверхностью, контактируют с кровью или инъекционными препаратами подлежат дезинфекции на месте.
Контроль качества предстерилизационной очистки изделий медицинского назначения
1 . Самоконтроль в ЛПУ проводят: в отделениях централизованной стерилизации (ОЦС) ежедневно.
Контроль качества предстерилизационной очистки на остаточное количество крови (азопирам, амидопириновая, проба НИРИ) - 10% от каждого наименования изделия обработанных за смену, но не менее 3–4 проб.
2 . Контроль качества на остаточное количество щелочи (фенолфталеиновая проба) - на каждую партию прополосканных в дистиллированной воде изделий не менее 3-4 проб.
Качество предстерилизационной очистки изделий оценивают путем постановки азопирамовой или амидопириновой пробы на наличие остаточных количеств крови, а также путем постановки фенолфталеиновой пробы на наличие остаточных количеств щелочных компонентов моющих средств.

4 . Методика приготовления реактивов для постановки проб
4 .1 . Азопирамовая проба
4.1.1.Приготовление исходного раствора.
Для приготовления 1 л (дм3) исходного раствора азопирама отвешивают 100 г амидопирина,1,0-1,5 г солянокислого анилина, смешивают их в сухой мерной посуде и доводят до объема 1 л (дм3) 95% этиловым спиртом. Смесь тщательно перемешивают до полного растворения ингредиентов.
Исходный раствор азопирама следует хранить в плотно закрытом флаконе в темноте. Допустимый срок хранения исходного раствора азопирама составляет 2 месяца при температуре 4°С (в холодильнике); при комнатной температуре (20 ±2 °С) - не более I месяца. Умеренное пожелтение исходного раствора в процессе хранения без выпадения осадка не снижает рабочих свойств раствора.
4.2.2. Приготовление реактива азопирам. Перед постановкой пробы готовят реактив азопирам, смешивая равные объемные количества исходного раствора азопирама и 3% раствора перекиси водороде. Реактив азопирам можно хранить не более 2 часов.
При более длительном стоянии может появиться розовое спонтанное окрашивание реактива. При температуре выше +25 °С раствор розовеет быстрее, поэтому его необходимо использовать в течение 30-40 мин. Не следует подвергать проверке горячие инструменты, а также хранить реактив азопирам на ярком свету и вблизи нагревательных приборов.
В случае необходимости пригодность реактива азопирам проверяют следующим образом: 2-3 капли реактива наносят на пятно крови. Если не позже чем через 1 мин появляется фиолетовое окрашивание, переходящее затем в сиреневый цвет, реактив пригоден к употреблению, если окрашивание в течение 1 мин не появляется, реактивом пользоваться не следует.
4 . 2 . Амидопириновая проба
Готовят 5% спиртовой раствор амидопирина на 95% этиловом спирте. Данный раствор должен храниться во флаконе с притертой пробкой в холодильнике.
Срок годности раствора - 1 месяц.
Готовят 30% раствор уксусной кислоты и 3% раствор перекиси водорода на дистиллированной воде.
Смешивают равные количества 5%спиртового раствора амидопирина, 50% раствора уксусной кислоты и 3%раствора перекиси водорода. Реактив готовят перед применением.
При постановке азопирамовой и амидопириновой проб окрашивание реактивов, наступившее позже чем через 1 мин после постановки пробы, не учитывается.
4 . 3 . Проба НИРИ (набор индикаторных растворов Искандарова)
Учет результатов ведется согласно прилагаемой инструкции.
4 . 4 . Фенолфталеиновая проба
Готовят 1% спиртовой раствор фенолфталеина на 95% этиловом спирте; раствор хранят во флаконе с притертой пробкой в холодильнике в течение месяца.
5 . Методика постановки проб
Контролируемое изделие протирают марлевой салфеткой, смоченной реактивом или наносят 2-3 капли реактива на изделие с помощью пипетки.
В шприцы вносят 3-4 капли рабочего раствора реактива и несколько раз продвигают поршнем для того, чтобы смочить реактивом внутреннюю поверхность шприца, особенно места соединения стекла с металлом, где чаще всего остается кровь; реактив оставляют в шприце на 1 мин, а затем вытесняют на марлевую салфетку. При проверке качества очистки игл реактив набирают в чистый, не имеющий следов коррозии шприц. Последовательно меняя иглы, через них пропускают реактив, вытесняя 3-4 капли на марлевую салфетку.
Качество очистки катетеров и других полых изделий оценивают путем введения реактива внутрь изделия с помощью чистого шприца или пипетки. Реактив оставляют внутри изделий на 1 мин, после чего сливают на марлевую салфетку. Количество реактива, вносимого внутрь изделия, зависит от величины изделия.
6 . Учёт результатов постановки проб
При положительной азопирамовой пробе в присутствии следов крови немедленно или не позднее, чем через 1 мин, появляется вначале фиолетовое, затем быстро в течение нескольких секунд переходящее в розово-сиреневое или буроватое окрашивание реактива.
Азопирам, кроме гемоглобина, выявляет наличие на изделиях остаточных количеств пероксидаз растительного происхождения (растительных остатков), окислителей (хлорамина, хлорной извести, стирального порошка с отбеливателем, хромовой смеси для обработки посуды и др.), а также ржавчины (окислов и солей железа)и кислот. При наличии на исследуемых изделиях ржавчины и указанных окислителей наблюдается бурое окрашивание реактива, в остальных случаях происходит окрашивание в розово-сиреневый цвет.
При положительной амидопириновой пробе о наличии на изделиях остаточных количеств крови свидетельствует немедленное или не позже чем через 1 мин после контакта реактива с кровью, появление сине-фиолетового окрашивания различной интенсивности.
При положительной фенолфталеиновой пробе о наличии на изделиях остаточных количеств щелочных компонентов моющего средства свидетельствует появление розового окрашивания реактива.
В случае положительной пробы на кровь или на остаточные количества щелочных компонентов моющих средств, всю группу контролируемых изделий, от которой отбирали контроль, подвергают повторной очистке до получения отрицательных результатов.
Результаты контроля отражают в журнале по форме № 366./У (см. ниже)


Составители: Маткаримов Б.Д., Сайлиева З.Д., Кудашева Л.В., Аллабергенова Н.М., Радкевич Т.Н., Диамант З.Ш., Ширеева Р.З.
← ctrl предыдущая следующая ctrl →
Дата принятия:
29.12.2007







