
Республики Узбекистан
Перинатальный
Центр
-
Контакты:
Адрес: ул. Дж. Абидовой 223
Телефон: +99871 260-28-80
Благодаря господдержке на рынок выведено 70 импортозамещающих российских ЛП
Фармацевтическая промышленность уже не первый год остается одной из самых динамично развивающихся отраслей российской экономики. Об основных итогах работы в 2017 году и о планах на наступивший год «Российской газете» рассказал заместитель министра промышленности и торговли России Сергей Цыб.
Сергей Анатольевич, отрасль сохраняет свои лидирующие позиции?
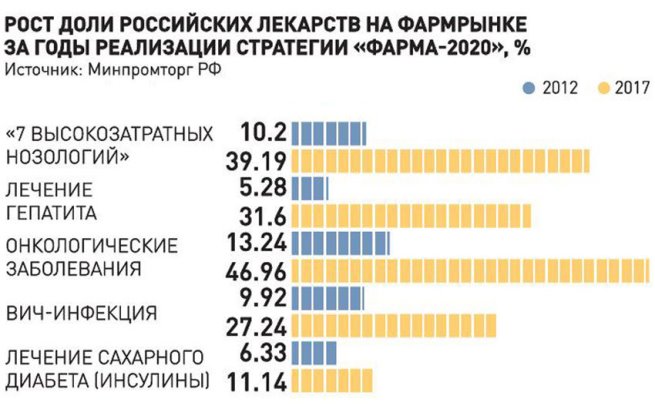
Пятый год подряд доля российских препаратов в общем объеме фармацевтического рынка растет. Сейчас она составляет уже 31,7 процента по сравнению с 24,1 процента в 2012 году. Выпуск собственных лекарств в важнейших сегментах при высоком качестве значительно экономит бюджетные средства, снижает зависимость российского здравоохранения от импорта лекарств. На 1 января наступившего года доля отечественных препаратов по номенклатуре перечня ЖНВЛП увеличилась до 84 процентов (в 2012 году их было 63 процента). В прошлом году рынок лекарственных препаратов из перечня ЖНВЛП в ценовой категории до 50 рублей в денежном выражении вырос по сравнению с аналогичным периодом 2016 года на 2,1 процента и на 3,8 процента — в натуральном виде.
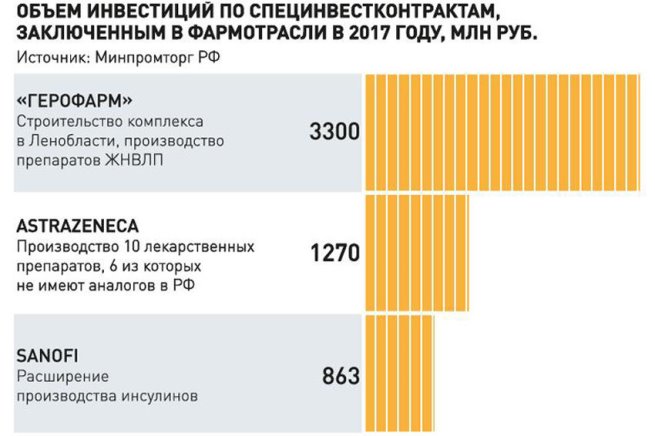
Объем экспорта фармпродукции в конечных ценах в 2017 году составил около 71 миллиона долларов США и вырос на 31,5 процента к аналогичному периоду 2016 года. Продолжают открываться фармацевтические производства. Запущена первая очередь завода «Фармасинтез-Норд», в ноябре состоялось официальное открытие завода «Озон Фарм», где будут производить лекарства из перечня ЖНВЛП. В 2017 году было зарегистрировано 25 российских конкурентоспособных препаратов, а всего с 2009 года — 70. В рамках программ поддержки трансфера высоких технологий и модернизации производства были заключены специнвестконтракты с крупными мировыми фармпроизводителями — компаниями Sanofi и AstraZeneca, а также отечественной высокотехнологичной компанией «Герофарм». На очереди подписание СПИК с компанией «НоваМедика» (входит в портфель «Роснано»).
Какие критерии были главными при выборе компаний, с которыми заключены специнвестконтракты? Есть ли перспективы заключить их у других участников рынка?
Первый критерий — готовность инвестора вложить в проект не менее 750 миллионов рублей собственных средств. Мы изучаем бизнес-план, смотрим, какую продукцию собирается производить предприятие, насколько она востребована на рынке. Конечно, приоритет отдается трансферу высоких технологий, производству инновационных препаратов. Компании, с которыми уже заключены СПИКи, производят высокотехнологичные лекарства. Изначально заявки подали 7 компаний, но число заявителей постоянно растет. В рамках СПИК мы готовы сотрудничать со всеми компаниями, желающими инвестировать в российское производство и соответствующие требованиям для заключения контракта.
Какие задачи стоят перед отраслью в 2018 году?
Нам предстоит серьезная работа сразу по двум направлениям. Первое связано с продолжением реализации государственной программы «Фарма-2020». Будем совершенствовать законодательную базу, связанную с госзакупками, активно привлекать новые инструменты поддержки отечественных производителей, углублять локализацию, расширять поддержку экспорта высокотехнологичной продукции.
Второе направление — формирование стратегии развития фармацевтической и медицинской промышленности до 2030 года. Продолжим и работу по созданию единого фармрынка стран Евразийского экономического союза.
Какие инструменты господдержки отрасли используются сейчас, какой эффект они дают?
В комплекс мер поддержки фармпромышленности входят как финансовые, так и нефинансовые инструменты. К финансовыми относятся субсидии на возмещение части затрат по клиническим исследованиям и организации производства фармсубстанций, а также субсидии на разработку схожих по фармакотерапевтическому действию и улучшенных аналогов инновационных лекарств. Фонд развития промышленности также выделяет займы на реализацию проектов в области фармацевтики. Кроме того, субсидируется ставка процента по инвестиционным кредитам.
Льготные преференции предусмотрены также для участников программы специнвестконтрактов. Как видите, министерство активно софинансирует все стадии создания лекарств: от этапа НИОКР по доклиническим исследованиям до выдачи льготных кредитов и субсидирования расходов на создание новых и модернизацию старых предприятий. Политика преференций последовательно проводится в отношении тех компаний, которые инвестируют в России, локализуют собственные производства, наращивают технологические компетенции.
В конце прошлого года вступил в силу Закон «О внесении изменений в Федеральный закон «Об обращении лекарственных средств». В нем предусмотрена, в частности, возможность госрегистрации препаратов с одинаковым МНН, но с различными торговыми наименованиями, произведенных на одной производственной площадке. Каково значение этого нововведения для отрасли?
Законопроект предусматривает возможность государственной регистрации препаратов с одинаковым международным непатентованным наименованием, но с различными торговыми наименованиями, при условии, что они выпущены на одной производственной площадке. Мы считаем, что эта поправка позволит создать благоприятные условия для размещения зарубежными компаниями контрактного производства лекарств в России.
Закон также изменяет порядок предоставления заключения о соответствии производителя требованиям правил GMP в ходе госрегистрации. В чем значение этой поправки?
Поправка позволит зарубежным производителям лекарств, которые уже продаются на российском рынке, осуществлять необходимые им регуляторные процедуры (продлевать срок действия регистрационного удостоверения, вносить изменения в него, которые не предусматривают включения новой производственной площадки, и т.п.), до завершения инспектирования их мощностей и получения заключения о соответствии требованиям GMP.
Законопроект позволяет производителю одновременно проводить и оценку его соответствия требованиям GMP, и экспертизу качества нового препарата. Это ускорит допуск на рынок самых современных инновационных лекарств. Фармкомпаниям проект закона разрешит производить препараты с одинаковым действующим веществом, но с разными торговыми наименованиями. Во-первых, это позволит загрузить мощности уже существующих предприятий и облегчить локализацию производств. Во-вторых, за счет усиления конкуренции цены будут снижаться, что сделает препараты более доступными.
Какие еще изменения в законе значимы для отрасли?
Важной является норма об обязательной маркировке лекарственных средств. Она предусматривает внедрение на всей территории РФ федеральной государственной информационной системы мониторинга движения лекарств от производителя до конечного потребителя с использованием средств идентификации. Система позволит потребителям контролировать происхождение каждой упаковки препарата и отслеживать его передвижение от производителя до аптеки. Это предотвратит попадание в обращение фальсифицированных лекарств.
Прошло уже пять лет с момента принятия госпрограммы «Фарма-2020». Можно ли подвести некие промежуточные итоги?
Когда мы запускали государственную программу «Развитие фармацевтической и медицинской промышленности» на 2013-2020 годы, то ставили перед собой задачу вернуть российской фармацевтике утраченные в 90-х годах позиции на отечественном рынке. Мы планировали создать инновационную модель производства, которая, с одной стороны, опирается на внутренний спрос и привлечение инвестиций в производство лекарств, а с другой стороны — на сотрудничество с лидерами мировой фарминдустрии, трансфер технологий, чтобы получить на выходе собственную научную и производственную инфраструктуру. Сегодня понятно, что процесс развивается в правильном направлении. Уже пятый год подряд мы наблюдаем рост доли российских препаратов в общем объеме фармацевтического рынка. В натуральном выражении каждая вторая таблетка — отечественного производства, точнее, 58 процентов.
За последние 5 лет в отрасль привлечено более 150 миллиардов рублей частных инвестиций иностранных и отечественных компаний при объеме средств федерального бюджета в 35 миллиардов рублей. При господдержке зарегистрировано и выведено на рынок 70 импортозамещающих российских препаратов. В целом в рамках госпрограммы поддержана разработка около 400 инновационных препаратов. Сейчас более 100 из них проходят клинические исследования, причем более 20 — уже на III и IV стадиях. Открыты 35 производственных площадок, в стране работают 500 предприятий фарминдустрии. В рамках трансфера высоких технологий иностранные фармкомпании построили 7 заводов. На площадках отечественных производителей свою продукцию локализовали 78 иностранных компаний, среди них такие производители, как Bayer, Janssen, Merck, Roche. Согласно госреестру лекарственных средств, всего локализовано более 360 международных непатентованных наименования. За пять лет мы создали хорошую базу для развития технологических компетенций в области биотехнологий. Растет экспортный потенциал российской фармпродукции. Она интересна не только на рынке Таможенного союза, но и в странах Латинской Америки, Ближнего Востока, Восточной Европы. Была разработана нормативно-правовая инфраструктура. Вырос институт лицензирования, появился инспекторат зарубежных производств. Все это послужит хорошим заделом для следующей стратегической программы.
В конце прошлого года принята новая редакция программы «Фарма-2020». Какие изменения в ней произошли?
В новой редакции госпрограммы «Развитие фармацевтической и медицинской промышленности» на 2013-2020 годы сохранены основные цели, задачи и индикаторы развития отрасли. Изменения коснулись технического переноса механизма финансирования госпрограммы и мероприятий, входящих в нее. Сегодня все инструменты сосредоточены непосредственно в госпрограмме, что облегчает управление ею.
Источник: gmpnews.ru






