
Республики Узбекистан
Перинатальный
Центр
-
Контакты:
Адрес: ул. Дж. Абидовой 223
Телефон: +99871 260-28-80
Система документации — управляем рисками
По роду своей деятельности (разработка системы электронного документооборота фармацевтической системы качества (ФСК) «Оптимус-ФАРМА» и добровольные аудиты фармпредприятий на соответствие требованиям правил надлежащей производственной практики) специалисты ООО «ЛексФАРМА» тесно сталкиваются с проблемами организации и поддержания системы документации фармацевтической системы качества. На основе своего практического опыта мы хотим предложить специалистам, работающим в производстве лекарственных средств, методологию проведения риск-менеджмента для оценки соответствия различных видов системы документации требованиям GMP.
«Старый» элемент — новые требования
Требования к системе документации были включены в правила надлежащей производственной практики (ПНПП, GMP) начиная с самых первых их изданий, которым сейчас уже более 50 лет. Необходимость разработки и поддержания большого количества документов даже привела к тому, что аббревиатуру «GMP» шуточно расшифровывают как «give more papеr». Все уже хорошо понимают, без системы документации невозможно соответствовать правилам GMP.
Ещё в начале 2000-х годов казалось, что Глава 4 «Документация» надлежащей производственной практики «традиционна», хорошо изучена и не таит в себе никаких неожиданностей. Для выполнения всех её положений надо только прописать довольно большое количество необходимых документов (процедур, инструкций, спецификаций и т.д.) и своевременно и аккуратно вести необходимые записи в журналах. Однако потом ситуация стала резко меняться.
Во-первых, на производственных площадках стали широко использоваться персональные компьютеры. Естественно, возникло желание каким-то образом компьютеризировать большой объём действий, проводимых в системе документации. Специалисты стали использовать возможности текстовых (Word) и табличных (Excel) процессоров, на некоторых предприятиях разрабатывались самостоятельно или приобретались системы электронного документооборота (СЭД).
Во-вторых, изменились, точнее, расширились сами требования правил надлежащей производственной практики, изложенные в главе 4 «Документация». В системе документации были чётко разграничены два вида документов: регламентирующие и регистрирующие документы (записи). Впервые были употреблены слова «шаблоны» и «формы», а в отношении записей применён термин «целостность». За несколько последних лет «целостность записей» или «целостность данных» стали одними их самых обсуждаемых понятий, а для их регулирования разработаны нормативные требования WHO[2], PIC/s[3], FDA[4]. В них «целостность» характеризуется как соответствие принципам ALCOA+, которые приведены в Таблице 1.
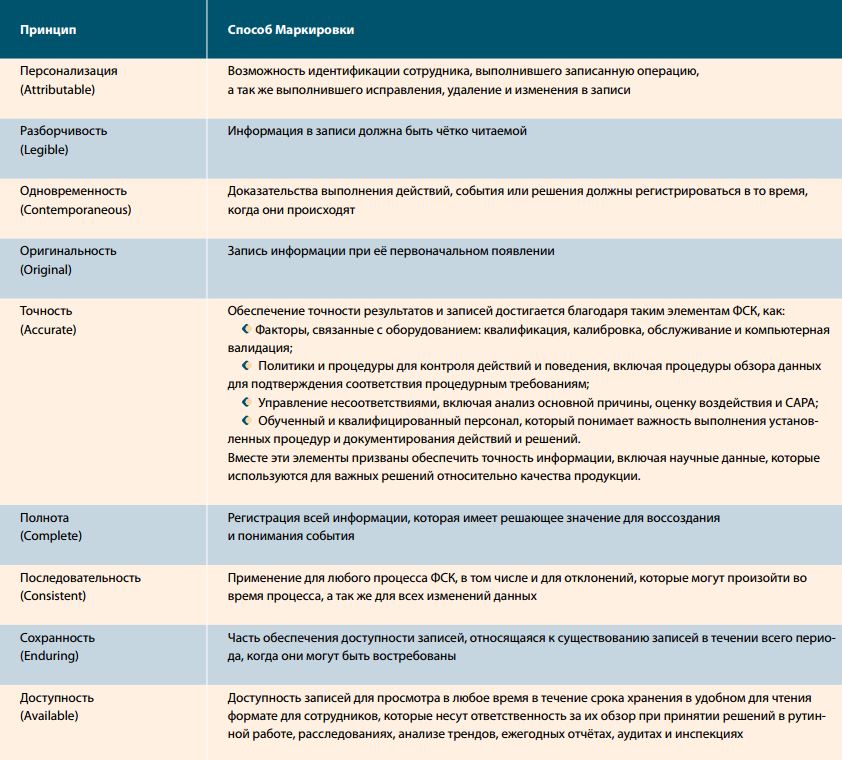
Таблица 1
В связи с расширением требований к системе документации (целостность данных, проведение контроля изменений в отношении документов) предприятия стали сталкиваться с тем, что в отношении такого «традиционного» раздела GMP, как «Документация», при проведении регуляторных инспекций возросли риски выявления всё большего количества несоответствий.
Есть риски? Значит ими надо управлять
Для Российских фармпредприятий управление рисками (или риск-менеджмент) является обязательным процессом фармацевтической системы качества с момента утверждения Правил организации производства и контроля качества (GMP) в 2013 году. Согласно Правилам GMP «уровень усилий, формализации и документального оформления процесса управления рисками для качества соответствует уровню риска». Поэтому очевидно, что риск-менеджмент стали использовать в процессах, наиболее критичных для качества продукции: валидации, мониторинге, утверждении производителей исходных материалов и т.д.
А является ли таким критичным процессом процесс управления документацией? Ответ дан в разделе «Принцип» Главы 4: «Документация составляет неотъемлемую часть фармацевтической системы качества и является ключевым элементом организации производства и контроля качества продукции в соответствии с настоящими Правилами». Следовательно, несоответствия в ключевом элементе обладают высоким уровнем риска и требуют соответствующего уровня усилий и документального оформления риск-менеджмента.
Глобальный риск для системы документации – это её несоответствие требованиям GMP. Это несоответствие может привести к негативному воздействию на здоровье пациента вследствие выпуска некачественной продукции (например, из-за ошибки в технологической инструкции). Так же могут быть негативные экономические и репутационные последствия в следствии выявления критических несоответствий в ходе регуляторных инспекций.
Для идентификации основых источников появления риска несоответствия системы документации (СД) требованиям GMP используем причинно-следственную диаграму (диаграмму Исикавы) см. Рисунок 1.
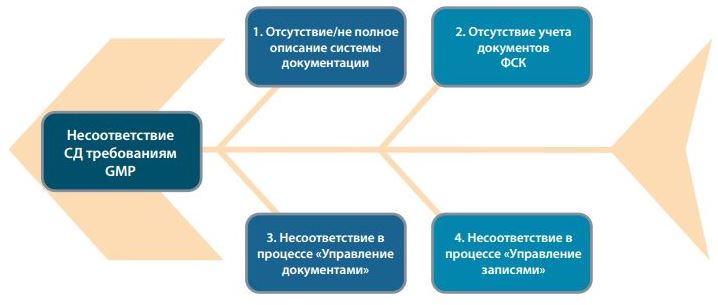
Рис.1 Диаграмма Исикавы для определения основных источников риска в системе документации
Бумага, компьютер, гибрид
Будем оценивать возможное влияние каждого источника риска на диаграмме Исикавы в зависимости от вида системы документации предприятия:
- бумажная;
- электронная;
- бумажно-электронная (гибридная).
Бумажная система документации
Исторически используется на фармпредприятиях и имеет такие преимущества, как «привычность» и неподверженность атакам компьютерных вирусов. На этом её достоинства, вероятно, заканчиваются. Все, кто использует «бумажную» систему, постоянно говорят о большом объёме трудозатрат по её поддержанию в нормальном состоянии. Проведём теперь идентификацию риска по каждому источнику.
- Обычно системы документации на бумажном носителе хорошо описаны. Все процессы регламентируются и регистрируются в одной системе документации. Есть схемы этой системы с перечнем всех видов используемых документов. Риск по этому элементу можно исключить.
- Учёт документов в этих системах обычно ведётся. Регламентирующие документы регистрируются в перечне документов. Учёт записей затруднён из-за их большого количества, но тоже вполне возможен. Риск по этому элементу тоже можно исключить.
- Правильное управление документами в бумажных системах очень трудозатратно, но, при желании и наличии трудовых ресурсов, вполне возможно. Например, если на предприятии детально прописан порядок действий при изготовлении учётных копий (что предполагает, в том числе, проставление номера копии на каждой странице каждой копии и использование какого-либо элемента, защищающего от несанкционированного копирования) и оно готово тратить средства на содержание сотрудников, выполняющих эту работу, то никаких рисков по несоответствию требованиям GMP по данному пункту у него не будет. Однако следует иметь в виду, что новые тенденции при проверке соответствия правилам надлежащей производственной практики (например, введение в действие новой версии документа теперь необходимо проводить через контроль изменений во всех связанных документах и регистрировать эти действия) требуют привлечения всё большего и большего количества сотрудников. Тем не менее риск по этому элементу можно исключить.
- Теперь об управлении записями. Следует признать, что выполнение некоторых принципов ALCOA+ в бумажных системах документации практически невозможно. Например, то, что полностью исключена возможность изменить первоначально внесённые данные (даже если они были записаны в хронологическом порядке в надежно скреплённом журнале с заранее проставленными номерами страниц – журналы тоже можно переписать…). Выдача бланков или журналов для ведения записей только отделом обеспечения качества этой проблемы тоже не решает – потому что при определённых условиях и отдел обеспечения качества может повторно выдать бланк и проставить дату выдачи «задним числом»… Регуляторные органы это хорошо понимают и поэтому их усилия при инспекциях теперь направлены на выявление потенциальной возможности фальсификации или удаления данных. Приёмам выявления таких возможностей посвящён целый раздел в проекте руководства для инспекторов PI 041-1 «(Draft 2) Good practices for data management and integrity in regulated GMP/GDP environments». Риск по данному элементу присутствует.
Окончательно диаграмма Исикавы для бумажных систем будет выглядеть так — см. Рисунок 2.
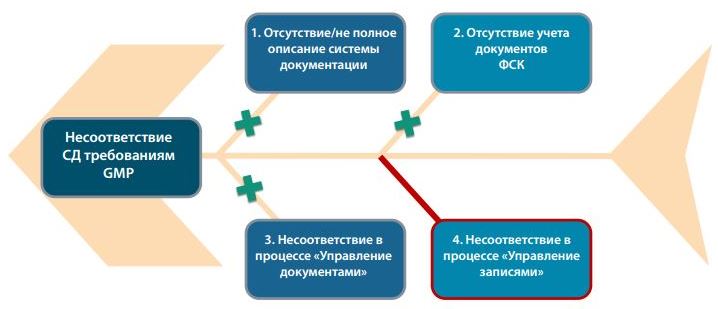
Рис.2 Диаграмма Исикавы для определения основных источников риска в бумажной системе документации
Второй вид систем документации — электронный.
Сначала о преимуществах — они очевидны (иначе государственный документооборот не переводился бы в электронный вид): уменьшение трудозатрат за счёт автоматизации большинства действий и легкого поиска информации, уменьшение места для хранения документов. Но всё это относится только к правильно разработанным и валидированным системам!!! Если этого не выполнено, то система электронного документооборота (СЭД) становится настоящим «ящиком Пандоры», из которого можно получить такие «подарки» как утрата или искажение информации. Поэтому в диаграмму Исикавы добавим такие элементы, как риск-анализ СЭД на соответствие требованиям GMP и её валидация.
О необходимости проведения риск-анализа электронной системы документации, особенно в отношении целостности записей, говорится в уже упоминавшемся проекте руководства для инспекторов PI 041-1 «(Draft 2) Good practices for data management and integrity in regulated GMP/GDP environments». Это требование совершенно обоснованно. Например, при проведении риск-анализа необходимо оценить, есть ли в системе техническая возможность удаления каких-либо данных или изменения календарных дат у какого-либо сотрудника предприятия, достаточны ли предлагаемые технические решения для сохранности информации (даже в условиях вирусных атак). То есть сначала надо показать, что СЭД реализует требования GMP по управлению документами и записями, а затем при валидации показать, что все опции, заложенные при разработке системы, функционируют надлежащим образом.
Не следует также забывать о таком требовании правил, как обеспечение понятности системы пользователю (для российских предприятий она должна быть на русском языке) и возможность её правильной эксплуатации (наличие руководства пользователя).
Таким образом, в лучшем случае (при наличии риск-анализа и пакета валидационной документации) все требования по описанию системы, учёту документов и записей, управлению документами и управлению записями будут реализованы и риски по ним будут исключены. Диаграмма Исикавы для такой компьютеризированной системы документации будет выглядеть следующим образом (Рисунок 3).
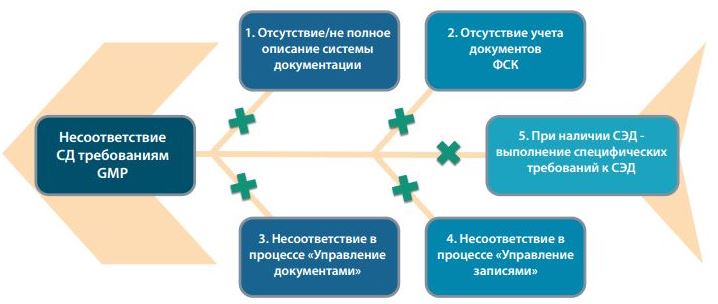
Рис.3 Диаграмма Исикавы для определения основных источников риска в валидированной и прошедшей риск-анализ электронной системе документации
В случае же отсутствия риск-анализа и/или пакета валидационных документов вид диаграммы драматически меняется в худшую сторону. В такой электронной системе документации невозможно гарантировать отсутствие риска ни по одному из рассматриваемых элементов (Рисунок 4).

Рис.4. Диаграмма Исикавы для определения основных источников риска в не валидированной и/или не прошедшей риск-анализ электронной системе документации
Считаем необходимым отметить, что если на предприятии используется несколько компьютеризированных систем документации, то обязательно необходим документ, описывающий всю систему документации в целом и области применения каждой из используемых систем. Без такого документа возникает риск невыполнения следующего требования GMP: «Комплексная система должна быть понятной, надлежащим образом документально оформленной…».
И, наконец, смешанный электронно-бумажный (или гибридный) вид системы документации.
Очевидно, что это самый сложный случай, так как в нём могут быть соединены все недостатки бумажной и электронной систем. Очень часто отсутствует полное описание системы документации, не выполняются отдельные требования по документообороту и целостности записей. При этом у таких систем есть очевидный огромный плюс – это то, что они являются первым шагом к системам полностью электронного документооборота.
Чем меньше бумажная часть системы документации и чем больше «правильная» электронная – тем меньше рисков идентифицируется. При такой конфигурации есть возможность использования положительных свойств как бумажной системы (возможность ведения записей и использование бумажных учётных копий персоналом, не имеющим доступ к компьютеру), так и электронной (уменьшение рутинных действий по управлению документами и обеспечению целостности записей).
Приходит время выбирать электронную систему документации
Вероятно, всем сотрудникам фармацевтических предприятий, от высшего руководства до рядовых исполнителей, очевидно, что время бумажной документации заканчивается и ей на смену неизбежно придёт документация электронная. Но её 100% внедрение сейчас сдерживают несколько факторов, в том числе:
- Консервативность, нежелание менять существующую, уже выдержавшую различные проверки, систему. Но как мы уже писали, требованиям по целостности записей бумажные системы документации полностью соответствовать уже практически не могут;
- Экономические затраты на покупку и поддержание СЭД и на компьютеризацию рабочих мест. Это тема для отдельной статьи, коротко можно сказать, что хорошие системы окупают себя в течение года за счёт экономии (по различным источникам) от 10 до 30% рабочего времени сотрудников, исключения ряда операций по поддержанию документооборота и экономии бумаги и ресурсов копировальной техники;
- Неуверенность предприятия в качестве приобретаемой электронной системы документации. Это самый критичный фактор. Правильный выбор СЭД – это во многом правильно заданный вектор развития фармацевтической системы качества на многие годы. Неправильный выбор – это риск несоответствия GMP со всеми вытекающими последствиями.
Сделать правильный выбор поможет риск-менеджмент. При выборе электронной системы документации предприятие находится в ситуации, «когда риски и их последствия, которыми необходимо управлять, являются разнообразными и представляют трудности для сравнения при применении только одного инструмента» (так формулируется возможная ситуация в «Рекомендациях по организации производства и контроля качества лекарственных средств, часть II Управление рисками»). В таких случаях рекомендуется использовать метод ранжирования и фильтрации. Он «заключается в разделении основной, связанной с риском, проблемы на множество компонентов, что необходимо для фиксации факторов, связанных с риском. Эти факторы объединяют в одну относительную шкалу рисков, которую можно применять для ранжирования рисков.»
Ниже приведена разработанная нами матрица ранжирования и фильтрации рисков при выборе электронной системы документации. В ней идентифицированы как риски несоответствия требованиям GMP, так и риски несоответствия требованиям пользователя, которые связанны с удобством пользования системой.
Общая проблема оценки СЭД была разделена нами на критические, существенные и дополнительные требования. Для каждого вида требований мы зафиксировали отдельные факторы оценки. Для построения шкалы требований в зависимости от критичности требования были использованы «исключающие» оценки или балльные оценки от «100» до «-100» и от «10» до «-10» соответственно.
В качестве нормативных требований указаны требования правил надлежащей производственной практики (ПНПП). В качестве нормативного документа, расширяющего требования GMP в отношении целостности записей использован проект PIC/s (PI 041-1 «(Draft 2) Good practices for data management and integrity in regulated GMP/GDP environments»), так как после утверждения он будет напрямую применяться при проведении GMP-инспекций.
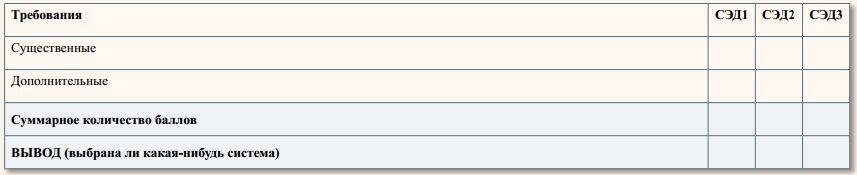
Для проведения риск-менеджмента мы рекомендуем предварительно выбрать несколько систем электронной документации. Затем провести оценку каждой системы согласно приведённой матрице. Для этого можно использовать данные, полученные из Спецификации на систему или от её разработчиков. Затем выбрать СЭД, получившую наибольшее количество баллов. Именно она при её внедрении на предприятии будет максимально исключать несоответствие системы документации требованиям GMP. Можно оценивать и одну систему. Здесь главное – чтобы она соответствовала всем критическим и существенным требованиям и большинству дополнительных требований.
Заключение
Конечно, данная матрица приведена в качестве примера. Каждое предприятие может разработать свои факторы оценки и методику их расчёта (не забывая, конечно, требования ПНПП).
Сейчас, на наш взгляд, наступает время компьютеризации фармацевтических систем качества. В современном фармпроизводстве явно виден разрыв между высокотехнологичным производственным и контрольно-испытательным оборудованием и бумажной системой документации, в которой документы хранятся в многочисленных папках, а записи по старинке ведутся в бумажных журналах или бланках.
Для ликвидации этого разрыва возможен лишь один путь – правильный, обоснованный анализом рисков выбор электронной системы документации. Без этого, система управления качеством может превратиться из фактора развития в фактор торможения.
Матрица ранжирования и фильтрации рисков при выборе электронной системы документации
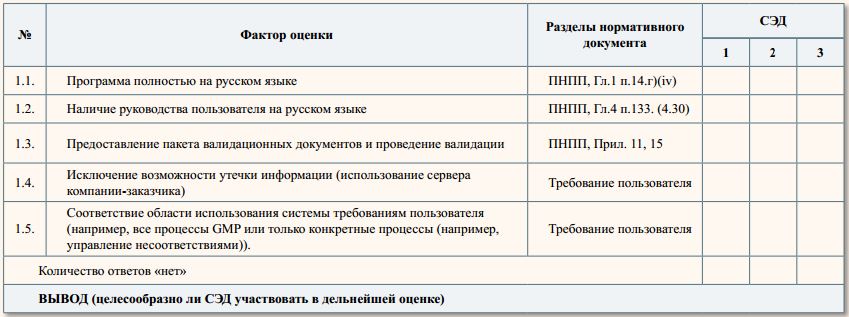
1. Критические требования
Невыполнение этих требований приводит к критическим рискам
Оценка: да/нет
При получении хотя бы одного ответа «нет» для требуемого фактора оценки система исключается из дальнейшей
оценки.
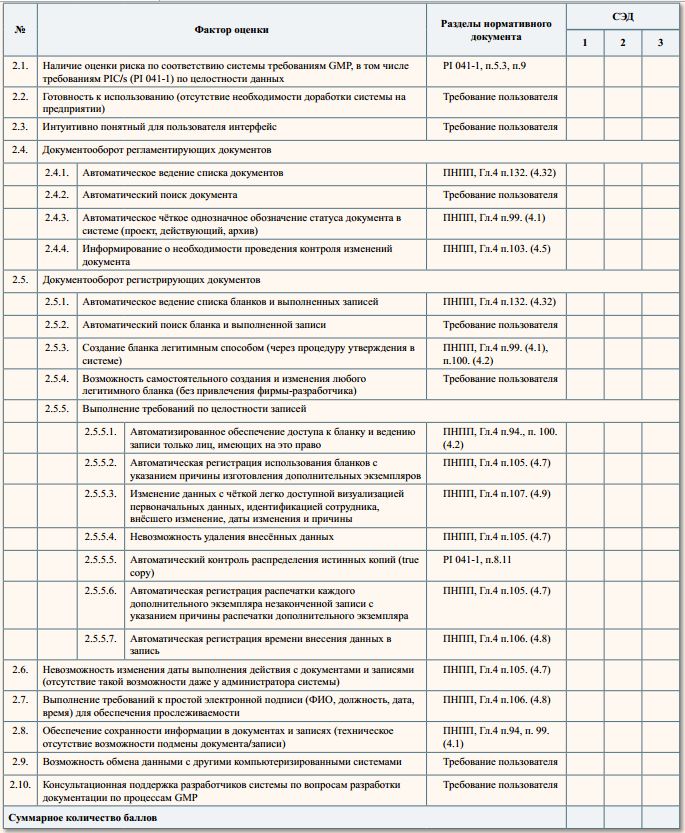
2. Существенные требования
Перечислены требования, невыполнение которых является критическим несоответствием требованиям GMP или
выполнение которых в ручном режиме требует большого количества рабочего времени
Оценка:
- полное соответствие требованию — «100»
- неполное соответствие (но возможна доработка) — «0»
- требование не реализовано: «-100»
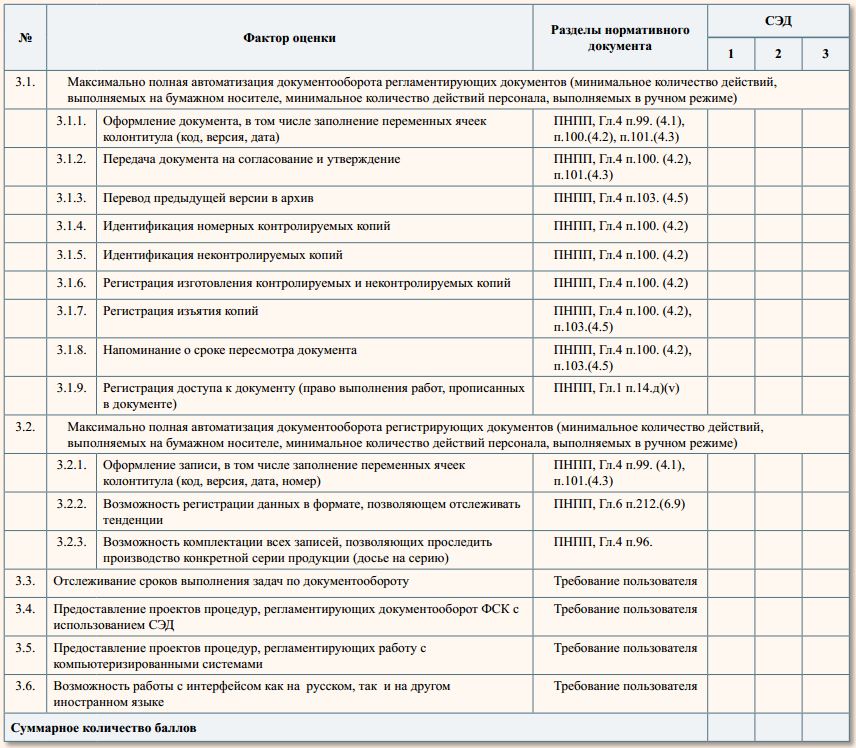
3. Дополнительные требования
В основном связаны со степенью автоматизации действий по документообороту, результатом чего будет уменьшение
ошибок, связанных с «человеческим фактором» и повышение производительности труда
Оценка:
- полное соответствие требованию — «10»
- неполное соответствие (но возможна доработка) — «0»
- требование не реализовано: «-10»
Итоговое количество баллов
Источник: gmpnews.ru






