Научно-исследовательский институт эпидемиологии
микробиологии и инфекционных заболеваний
 Назад
Назад
1. После того как я начал принимать, выписанные мне антибиотики, у меня начался понос. Почему это происходит? Появление поноса на фоне приема...
2. Можно ли при дисбактериозе кишечнике употреблять молоко? ребенку 2 года, иногда даю пить кипяченое молоко ему, и каши на молоке едим каждый день. Ребенка рвет во время еды. Кроме рвоты ничего не беспокоит: ни болей в животе, ни поноса, ни температуры нет Строгого противопоказания...
3. Может ли дисбактериоз вызвать запор у взрослого? Да, хотя при дисбактериозе...
1. Знаете ли Вы, что избавиться от глистов навсегда просто невозможно! Есть...
2. Знаете ли Вы, что при глистной инвазии происходит дефицит макро и микро...
3. Знаете ли Вы, что упущенное в детстве лечение некоторых глистных инвазий,...
Календарь событий
Указом Президента РФ от 12.05.2009 N 537 (ред. от 01.07.2014) «О Стратегии национальной безопасности Российской Федерации до 2020 года» установлено, что «одним из главных направлений обеспечения национальной безопасности в среднесрочной перспективе определяется продовольственная безопасность и гарантированное снабжение населения высококачественными и доступными лекарственными препаратами».
От качества и безопасности лекарственных средств во многом зависит жизнь и здоровье человека. Поэтому все лекарственные средства, произведенные на территории Российской Федерации и ввезенные из-за границы, подвергаются государственному контролю, неотъемлемой частью которого является лабораторный контроль. Участие в процессе государственного контроля и подтверждения соответствия лекарственных средств могут осуществлять аккредитованные Испытательные лаборатории (центры).
Аккредитация испытательных лабораторий признана во всем мире как квалифицированная и объективная процедура оценки компетентности. На основании опыта работы по аккредитации в промышленно развитых странах и в России, международных правил и рекомендаций ИСО/МЭК по аккредитации испытательных лабораторий, принятия российских законодательных, правовых и нормативных документов, постепенно осуществляется выработка национальным органом по аккредитации в целом более четких требований к компетентности лабораторий и эффективных приемов объективной оценки (подтверждения) этой компетентности.
Соответствие действующих правил по аккредитации в Российской Федерации международным правилам и рекомендациям является показателем адекватности технической компетентности объектов аккредитации и обеспечивает уверенность в надежности результатов испытаний. Гармонизация с международными стандартами действующих российских нормативных правовых актов постепенно актуализирует критерии аккредитации лабораторий как в части технических требований к лабораториям, так и требований к управлению лабораторной деятельностью, и, прежде всего, к результативности и эффективности
системы менеджмента качества, к специалистам, проводящим испытания, и к методам контроля качества проведения испытаний.
Аккредитованным в национальной системе аккредитации испытательным лабораториям в сфере контроля лекарственных средств постоянно приходится осуществлять систематическую, активную организационно-методическую и материально-техническую деятельность по поддержанию соответствия критериям и требованиям, установленных законодательством в сфере аккредитации.
Возможность успешно подтвердить аккредитацию для лабораторий, осуществляющих деятельность в сфере контроля качества лекарственных средств, определяется, в первую очередь, системой менеджмента качества внутренних процессов, позволяющей достигать стабильно высокого уровня управляемости ресурсами (персонал, материалы, оборудование, инфраструктура) при минимальных издержках. Во вторую очередь, эффективная система управления обеспечивает наличие доказательств качества и достоверности полученного лабораторного результата, а, следовательно, гарантии качества лабораторной услуги для всех заинтересованных в деятельности организации сторон. Безусловно, обе перечисленные задачи должны аккредитованными лабораториями решаться параллельно.
Рассмотрим подходы внедрения и функционирования отдельных элементов СМК в испытательной лаборатории на основе обеспечения соответствия требованиям, предъявляемым к испытательным лабораториям (центрам), утвержденным приказом Минэкономразвития России от 30 мая 2014 г. №326 «Об утверждении Критериев аккредитации, перечня документов, подтверждающих соответствие заявителя, аккредитованного лица критериям аккредитации, и перечня документов в области стандартизации, соблюдение требований которых заявителями, аккредитованными лицами обеспечивает их соответствие критериям аккредитации» и требованиям ГОСТ ИСО/МЭК 17025-2009 «Общие требования к испытательным и калибровочным лабораториям».
Для успешного внедрения и функционирования СМК должна быть сформирована эффективная организационная структура организации, исходя из рационального разделения функций между структурными подразделениями и сбалансированности уровней менеджмента.
Содержание работ по совершенствованию внутренней организации деятельности (см. табл.1).
Таблица 1. Совершенствование организационной структуры
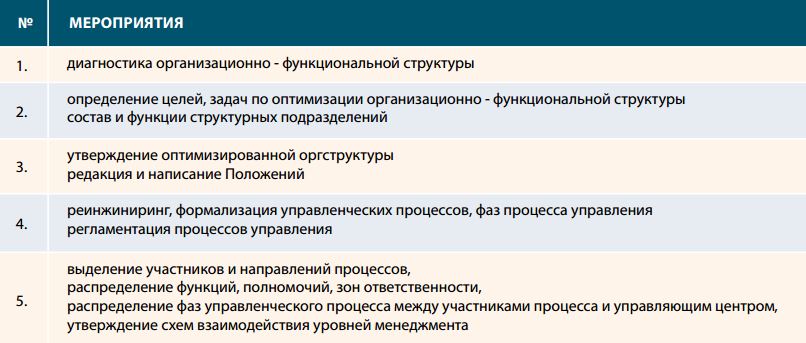
Организационная структура имеет многофункциональное назначение:
- должна быть направлена на развитие и адаптацию к внешней среде, быть достаточно эластичной для восприятия изменений,
- обеспечивать механизм принятия управленческих решений, позволяющего устранять противоречия и устанавливать разумные компромиссы между различными структурными подразделениями,
- обеспечивать меры по независимости, беспристрастности и конфиденциальности.
При подходе к управлению на основе качества необходимы фундаментальные изменения в традиционной роли руководства в ходе планирования, управления и контроля. Руководители обеспечивают единство цели и направления деятельности организации. Им следует создавать и поддерживать внутреннюю среду, в которой работники могут быть полностью вовлечены в решение задач организации.
Высшим руководством определяется политика и стратегические цели организации в области качества. Политика в области качества отражает общие намерения и направление деятельности организации в области качества и устанавливает цели, официально сформулированные высшим руководством в заявлении о политике в области качества. Этим заявлением высшее руководство обеспечивает уверенность в том, что цели в области качества установлены для всех соответствующих направлений деятельности и подразделений организации.
В целях динамичного внедрения СМК наиболее целесообразным представляется создание отдела управления качеством в структуре организации с полномочиями прямого доступа к высшему руководству и руководителям среднего звена.
При анализе системы внутренней организации деятельности лаборатории пересматривается и анализируется деятельность организации в целом, при этом становятся очевидны нестыковки в системе управления, в дублировании ответственности, в нарушении установленных правил – в связи с этим нередко принимаются решения о перераспределении функций и ответственности персонала.
Распределение ответственности и полномочий в испытательной лаборатории один из важных аспектов эффективной внутренней организации деятельности. Зоны ответственности, полномочий и сферы влияния должны быть четко определены и согласованы между собой. Для этого должен быть утвержден и оформлен документально порядок управления персоналом, где установлены правила оценки компетентности, квалификации специалистов, допуска к работам, наделения полномочиями, закрепление ответственности и форма реализации этих аспектов в условиях взаимосвязанных процессов организации.
Одним из важнейших факторов, влияющих на внедрение и развитие системы управления является обучение персонала актуальным вопросам управления качеством, по современным управленческим подходам лабораторной деятельностью (представителей руководства, представителей по качеству, внутренних аудиторов).
Уровень квалификации специалистов, участвующих в обеспечении работ по испытаниям, отбирающих образцы для испытаний, проводящих испытания и оценивающих результаты испытаний, определяет, в конечном итоге, признанное качество этих работ обеспечивает доверие потребителей к компетентности лабораторий, доверие к результатам проведенных ими исследований, испытаний, измерений. Именно поэтому проблеме оценки компетентности персонала лабораторий в национальной системе аккредитации уделяется самое пристальное внимание. Соответственно, аккредитованные лаборатории должны создать практический механизм обеспечения и оценки компетентности своего персонала. Процедура внутренней и внешней (независимой) аттестации специалистов может рассматриваться как один из способов такой оценки и своеобразная степень признания уровня квалификации специалиста в аттестуемом направлении деятельности. Критерии аттестации персонала устанавливаются на основе
требований к профессиональному образованию и образовательному уровню, специальной подготовке и практическому опыту работы, способности к систематизации и анализу, и как результат, установление уровня компетентности и дифференцированного допуска к испытаниям, оборудованию и иным работам.
Сегодня лаборатории при прохождении аккредитации или подтверждении компетентности аккредитованного лица, недостаточно убедительно демонстрируют, что компетентность всех, кто работает со специальным оборудованием, проводит испытания, оценивает результаты и подписывает протоколы испытаний основана на квалифицированной беспристрастной оценке каждого работника и что имеется дифференцированный подход наделения функциональными полномочиями. Кроме того, если процедура аттестации персонала не осуществляется по формальному принципу, то система аттестации может стать эффективным инструментом для выявления потребностей в подготовке, планирования и осуществления подготовки персонала, а также оценке результативности проведенного обучения.
При осуществлении процедуры аккредитации и подтверждения компетентности значимым является способность организации продемонстрировать жизнеспособность созданной СМК.
Объем документированных процедур, правил и инструкций обусловлен такими факторами, как размер организации, квалификация персонала сложность деятельности и взаимодействие процессов, а также должна учитываться глубина процессов, до которой необходимо подтверждать выполнение требований к системе менеджмента качества в соответствии с законодательными и нормативными обязательным требованиям в сфере аккредитации. Целью оценки данного процесса при аккредитации является установление адекватности и достаточности процедур, посредством регламентации записей об их исполнении. Разработка документированных процедур добавляет ценность осуществляемым процессам в плане подтверждения их достоверности, дает возможность передать смысл и последовательность действий, позволит оценить эффективность и пригодность системы менеджмента качества.
Лаборатории должны стремиться самостоятельно оценивать пригодность СМК, выявлять степень сопоставимости требований СМК и их исполнение, выявлять взаимосвязь процессов и ресурсы для постоянного улучшения системы. Каждый процесс, прежде всего, это часть системы и изменения его могут повлечь за собой изменения других взаимосвязанных элементов системы. Самооценка процесс длительный и трудоемкий, требующий специальной подготовки, навыков персонала, осуществляющего такую оценку и к сожалению, лаборатории, уделяют этому недостаточно внимания.
При условии, что руководители лабораторий непосредственно заинтересованы в том, чтобы система функционировала в полном объеме, и учитывая наличие четкой структуры и нормативной регламентации деятельности, возможно предположить, что персонал не будет иметь «белых пятен» при исполнении своих функций и организация не будет испытывать трудности при проведении аккредитационных аудитов.
Наряду с общими подходами к обеспечению успешного прохождения процедуры аккредитации и подтверждения компетентности, для лабораторий в сфере контроля качества лекарственных средств присутствуют и некие особенности, обусловленные спецификой нормативного обеспечения документами, регламентирующими методы исследований, испытаний и самой системой нормирования требований к объектам исследований.
16 февраля 2017 г. Минюстом России зарегистрирован приказ Минэкономразвития России от 29 ноября 2016 г. №764 «О внесении изменений в некоторые приказы Минэкономразвития России по вопросам аккредитации в национальной системы аккредитации», в том числе в Приказ Минэкономразвития России от 26.05.2014 №295, где установлены требования к формированию области аккредитации испытательной лаборатории и определено, что в столбце 2 области аккредитации «указываются документы, содержащие в себе совокупность конкретно указанных операций, выполнение которых обеспечивает получение результатов измерений с установленными показателями точности. При заполнении указываются: реквизиты документа, устанавливающего правила и методы исследований (испытаний) и измерений, в том числе конкретные пункты, содержащие правила и методы исследований (испытаний) и измерений, заявленные на аккредитацию», «в столбце 7 указывается диапазон определения отдельно для каждого документа, указанного в столбце 2».
Данное требование вызвало определенные трудности при формировании области аккредитации у лабораторий в сфере контроля качества лекарственных средств.
Фармацевтический анализ имеет свои специфические особенности, отличающие его от других видов анализа. Эти особенности заключаются в том, что анализу подвергают вещества различной химической природы: неорганические, элементорганические, радиоактивные, органические соединения от простых алифатических до сложных природных биологически активных веществ. Чрезвычайно широк диапазон концентраций анализируемых веществ. Объектами фармацевтического анализа являются не только индивидуальные лекарственные вещества, но и смеси, содержащие различное число компонентов. Количество лекарственных средств с каждым годом увеличивается. Это вызывает необходимость разработки новых способов анализа и, соответственно, расширять область компетентности аккредитованной лаборатории.
Фармацевтический анализ в зависимости от поставленных задач включает различные формы контроля качества лекарств: фармакопейный анализ, постадийный контроль производства лекарственных средств, анализ лекарственных форм индивидуального изготовления, экспресс-анализ в условиях аптеки и биофармацевтический анализ. Составной частью фармацевтического анализа является фармакопейный анализ. Он представляет собой совокупность способов исследования лекарственных препаратов и лекарственных форм, изложенных в Государственной фармакопее или другой нормативно-технической документации (ОФС, ФС). После выхода в Российской Федерации XIII издания Государственной фармакопеи осуществляется разработка общих фармакопейных статей (ОФС) и фармакопейных статей (ФС) на современные методы анализа, лекарственные формы и общие методы. Фармакопейный анализ лекарственных субстанций и различных лекарственных форм проводится строго по методикам, заложенным в Государственную фармакопею, соответственно в области аккредитации в качестве документа, устанавливающего правила и методы исследований (испытаний) и измерений указываются статьи государственной фармакопеи (ОФС, ФС).
Вместе с тем, общие фармакопейные статьи не могут детализировать конкретные требования к постадийному аналитическому контролю, поскольку многообразие технологий производства лекарственных средств, большая номенклатура химических соединений, участвующих в синтезе, создают высокую степень вариации различных смесей, требующих определения их состава. По этой причине возникает необходимость в разработке многочисленных нестандартных методик анализа (ФСП). Необходимость их метрологического обеспечения не вызывает сомнений и выражается в аттестации разрабатываемых и применяемых методик анализа.
Исходя из изложенного выше, следует, что к нормативным документам, регламентирующим методики анализа лекарственных средств, предъявляются различные требования, определяющие степень метрологического обеспечения.
В постадийном аналитическом контроле в процессе производства и особенно в фармакопейном контроле качества готовых лекарственных средств стандартным образцам придается весьма важное значение, одновременно, проблема наличия и обеспечения государственными стандартными образцами является одной из особенностей аналитических исследований лекарственных средств.
В анализе лекарственных средств могут использоваться стандартные образцы соединений, разработанные в процессе производства, а затем охарактеризованные и идентифицированные химическими, физико-химическими и другими методами; в отдельных случаях, методикой исследований предусматривается применение стандартизованной смеси соединений или искусственно составленной смеси соединений. Этот вид стандартов не требует метрологической аттестации и не может рассматриваться как стандартный образец в общепринятом метрологическом понимании. Особую группу стандартных образцов составляют государственные стандартные образцы (ГСО), которые используются для контроля качества лекарств — как субстанций, так и готовых лекарственных форм. Требования к государственным стандартным образцам для контроля лекарственных средств и порядок их разработки и применения регламентируют нормативные документы. В документах перечислены все разделы (показатели и нормы качества) фармакопейной статьи на государственные стандартные образцы в зависимости от природы вещества, технологии его получения и области применения ГСО.

Нами рассмотрены отдельные аспекты обеспечения соответствия требованиям в сфере аккредитации лабораторий по исследованиям лекарственных средств, необходимость дальнейшей методической проработки которых очевидна, поскольку в среде аккредитованных лиц присутствует замешательство и непонимание «правильной модели деятельности». Представляется целесообразным для лабораторий контроля лекарственных средств углубленно рассматривать направление применения специальных рекомендаций и подходов по формированию области аккредитации.
Переосмысление имеющихся практических подходов, в конечном счете, приведет к единообразию схем оценок и единообразию трактовки законодательных и нормативных требований при оценке соответствия аккредитованных лиц в сфере контроля качества и безопасности лекарственных средств.
Источник: gmpnews.ru
19.10.2024
Южнокорейская HAEAHN разработала мастер-план медкластера в Новом Ташкенте стоимостью $500 млн
Компания из Южной Кореи HAEAHN Architecture разработала мастер-план медицинского кластера на 420 га в...
18.10.2024
Видеоинтервью: Медицина как бизнес, самодиагностика и самолечение
Мы всегда знаем, какой врач нам нужен, хотя к узким специалистам пациентов направляет терапевт. Но мало...
18.10.2024
Дети с инвалидностью будут учиться в юридических техникумах бесплатно
Принято постановление Кабинета Министров Республики Узбекистан «О внесении изменений и дополнений в некоторые...






