Научно-исследовательский институт эпидемиологии
микробиологии и инфекционных заболеваний
 Назад
Назад
1. После того как я начал принимать, выписанные мне антибиотики, у меня начался понос. Почему это происходит? Появление поноса на фоне приема...
2. Можно ли при дисбактериозе кишечнике употреблять молоко? ребенку 2 года, иногда даю пить кипяченое молоко ему, и каши на молоке едим каждый день. Ребенка рвет во время еды. Кроме рвоты ничего не беспокоит: ни болей в животе, ни поноса, ни температуры нет Строгого противопоказания...
3. Может ли дисбактериоз вызвать запор у взрослого? Да, хотя при дисбактериозе...
1. Знаете ли Вы, что избавиться от глистов навсегда просто невозможно! Есть...
2. Знаете ли Вы, что при глистной инвазии происходит дефицит макро и микро...
3. Знаете ли Вы, что упущенное в детстве лечение некоторых глистных инвазий,...
Календарь событий
9 января 2017 г. произошло примечательное для российского фармацевтического рынка событие: в Министерстве Юстиции был зарегистрирован Приказ 646н от 31.08.2016 г. «Правила надлежащей практики хранения и перевозки лекарственных препаратов для медицинского применения» (далее Правила), относящийся ко всем субъектам обращения лекарственных препаратов. Одновременно был зарегистрирован Приказ 647н от 31.08.2016 г. «Правила надлежащей аптечной практики лекарственных препаратов для медицинского применения».
Примечательным, на мой взгляд, это событие является, как минимум, по двум причинам:
- Появление совершенно нового типа нормативного документа в сфере дистрибуции лекарственных препаратов. Надлежащие практики, которые участники фармацевтического рынка обобщенно обозначают «Правила GxP», требуют наличия в организации внедренной Системы Менеджмента Качества, выполняющей роль фундамента для построения процессов согласно нормативам той или иной надлежащей практики (GLP, GMP, GDP, GSP и др.). При этом, требования, указанные в надлежащих практиках, не дают прямого указания на способ выполнения данного требования, а обязуют субъекта обращения лекарственных средств самостоятельно обосновывать необходимость и достаточность принятых мер, направленных на выполнение требований правил надлежащих практик.
- Относительно безболезненное внедрение Правил в правовое поле. Невольно напрашивается сравнение с историей появления «Правил организации производства и контроля качества лекарственных средств», Приказ Минпромторга России от 14.06.2013 N 916 (Правила GMP). Правила GMP, как известно, проделали долгий и трудный путь в Российской Федерации, а до этого еще в СССР, прежде чем получили статус официального документа. Одним из часто упоминаемых препятствий для принятия Правил GMP называлось неготовность рынка жить по современным стандартам производства. Приказ 646н, который вступит в силу уже 01 Марта 2017 г., т.е. спустя менее двух месяцев со дня его официального опубликования, будет регулировать деятельность порядка 112000 организаций, занимающихся оптовой и розничной торговлей лекарственных средств, включая около 2500 организаций оптовой торговли и 82000 аптек и аптечных пунктов (По данным Росздравнадзора на июль 2016 года).
Посмотрим более подробно на то, как эволюционировало российское нормативно-правовое поле, регламентирующее порядок хранения и транспортировки лекарственных препаратов; насколько субъекты дистрибуции лекарственных препаратов готовы к работе в соответствии с Правилами, какие сложности могут возникнуть при переходе на новый норматив, какой уровень гармонизации с международными стандартами при этом будет обеспечен, а также какой уровень соответствия требованиям международным практикам демонстрируют участники фармацевтического рынка.
Развитие нормативно-правового регулирования хранения и перевозки лекарственных средств 1950-2016 гг.
В советское время нормативные акты, определяющие порядок хранения лекарственных средств, на протяжении длительного времени не менялись. Приведем несколько примеров: Условия и правила хранения медикаментов и других медицинских предметов, утвержденные Главным аптечным управлением Минздрава СССР 10 июня 1953 г., были отменены только в 1981 г., когда вступил в силу Приказ Минздрава СССР №510 от 15 мая 1981 г. Об утверждении «Инструкции по организации хранения в аптечных учреждениях различных групп лекарственных средств и изделий медицинского назначения», просуществовавший в неизменном виде до 1996 г. Указанные документы определяли техническую оснащенность помещений для хранения лекарственных препаратов, параметры окружающей среды, возможность совместного хранения препаратов, принадлежащих к различным фармакотерапевтическим группам, отличающихся физико-химическими свойствами. Приказ №510 определял топологию стеллажей, места для размещения приборов для мониторинга температуры и влажности.
В апреле 1998 г. была утверждена Программа работ по созданию и развитию Системы стандартизации в здравоохранении, в которой было указано на необходимость внедрения надлежащих практик, регламентирующих все этапы обращения лекарственных препаратов, начиная с проведения клинических исследований, заканчивая хранением продукции в аптечных учреждениях. Предполагалось, что уже к октябрю 1998 г. будут разработаны отраслевые руководящие документы, определяющие, в частности, правила оптовой и розничной торговли. Эта работа с бюджетом в 60 тыс. рублей была поручена ММА им. Сеченова, НИИ Фармации и ВНИИ Стандарт. Вероятно, агрессивные сроки при, мягко говоря, скромном финансировании не позволили завершить задуманное в срок.
В 2002 г. на смену Приказу №510 пришел отраслевой стандарт ОСТ 91500.05.0005-2002, разработанный для оптовой торговли лекарственными препаратами, «Правила оптовой торговли лекарственными средствами», утвержденный Приказом Минздрава РФ №80 от 15 марта 2002 г. Позднее в 2003 г. был утвержден Приказ Минздрава РФ №80 от 04 марта «Правила отпуска (реализации) лекарственных средств в аптечных организациях». Основное внимание в указанных документах уделено технической оснащенности помещений и порядку учета лекарственных препаратов. При этом в Правилах оптовой торговли от 2002 г. впервые появился раздел о мерах по обеспечению качества, необходимых к внедрению организацией оптовой торговли, где говорится об обязанности руководителя предприятия назначить Уполномоченного по качеству; введено требование проводить внутренние проверки на соответствие деятельности предприятия требованиям отраслевого стандарта; установлено обязательное требование по ознакомлению всех сотрудников предприятия с требованиями стандарта.
На практике внедрение отраслевого стандарта, определяющего правила оптовой торговли, не имело существенного влияния на фармацевтическую деятельность в контексте вопросов обеспечения качества, как минимум по двум причинам:
- Весьма поверхностное описание мер по обеспечению качества, которые могут работать только тогда, когда представляют собой взаимосвязанные элементы системы менеджмента качества. Напомню, что в отличие от российского ОСТа, Надлежащие правила дистрибуции 94С 63/03, утвержденные в Европейском Экономическом Сообществе в 1994 г. и действовавшие до 2013 г., содержали ссылки на действующие Надлежащие правила производства (GMP), а также концепцию менеджмента качества, описанную в серии стандартов ИСО 9000 (на тот момент CEN 29000).
- Фрагментарность требований определила их более чем формальное исполнение участниками рынка.
В 2010 г. были опубликованы два приказа Минздравсоцразвития №706н от 23 августа «Правила хранения лекарственных средств» и №1222н от 28 декабря «Правила оптовой торговли лекарственными средствами для медицинского применения». Последний документ отменил действие ОСТа 91500.05.0005-2002.
Новые Правила были составлены в духе документов, определяющих требования к обращению с лекарственными препаратами 50-х – 80-х годов. Достаточно упомянуть требования к месту размещения приборов для температурного мониторинга, а также порядку размещения стеллажей, которые на протяжении десятилетий не менялись, и мало кто может обосновать их практическую целесообразность в условиях современной технологии постройки складов, не говоря уже об автоматизации процессов и применения робототехники. При этом с появлением приказов 706н и 1222н исчезло понятие обеспечения качества. Как указано выше, в том виде, в каком оно было введено в ОСТ, толку от него было немного, но так или иначе вместо движения вперед навстречу надлежащим практикам, о необходимости внедрения которых говорилось в Программе работ по созданию и развитию Системы стандартизации в здравоохранении (1998 г.), явно был сделан шаг назад.
Разговоры о необходимости внедрения надлежащих практик дистрибуции возобновились с развитием идеи формирования единого рынка обращения лекарственных средств на территории Евразийского союза. По условиям Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23 декабря 2014 г. Ст. 11 «Оптовая реализация, транспортирование и хранение лекарственных средств на территориях государств-членов осуществляются в соответствии с правилами надлежащей дистрибьюторской практики, утверждаемыми Комиссией [Евразийского экономического союза (ЕАЭС)]».
Подробней о правилах надлежащей дистрибьюторской практики ЕАЭС скажем чуть позднее. А пока продолжим разбираться с российской нормативно-правовой базой. Согласно федеральному закону 429-ФЗ от 22 декабря 2014 г. Ст. 54 федерального закона 61-ФЗ Об обращении лекарственных средств была дополнена указанием на необходимость обращения лекарственных препаратов в соответствии с правилами надлежащей дистрибьюторской практики, а также правилами надлежащей практики хранения и перевозки лекарственных препаратов. При этом до появления приказа 646н, о котором уже было сказано в начале статьи, основным документом, регламентирующим оптовую торговлю лекарственными средствами, оставался приказ 1222н, который, даже с натяжкой, на роль надлежащих практик не подходит.
В январе 2015 г (Дата приводится согласно информации Портала). на Федеральном портале проектов нормативных правовых актов были размещены проекты правил надлежащей дистрибьюторской практики и правил надлежащей практики хранения и перевозки лекарственных препаратов. Правила надлежащей дистрибьюторской практики, подготовленные МЗ РФ, являлись усеченным, практически в два раза, вариантом проекта (на тот момент) Правил надлежащей дистрибьюторской практики ЕАЭС с рядом корректировок понятийного аппарата. Проект правил надлежащей практики хранения во многом повторял проект правил надлежащей дистрибьюторской практики, при этом в первом документе был дан ряд ссылок на действующие российские нормативы, например, на российскую фармакопею, порядок хранения различных групп препаратов, таких как сильнодействующие и наркотические средства.
Изначально идея регулятора иметь два аналогичных по своей сути и содержанию документа, регламентирующих деятельность одних и тех же субъектов обращения лекарственных средств на одних и тех же этапах обращения продукции, непонятна.
Из-за того, что какие-то разделы из правил надлежащей дистрибьюторской практики, например, раздел помещение и оборудование, транспортировка, перекочевали в Правила хранения и транспортировки был нарушен принцип разработки надлежащих практик, подразумевающий целостный процессный охват регулируемой деятельности. Кроме того, не будем забывать, что в основе проекта Евразийских правил надлежащей дистрибьюторской практики, который использовался российским регулятором, лежал европейский документ «Правила надлежащей дистрибьюторской практики (2013/C 343/01)», утвержденный в 2013 г. В результате двукратного сокращения содержания оригинала мы получили весьма фрагментарный норматив, не решающий основную задачу: обеспечение качества лекарственных препаратов в процессе их дистрибьюции. Представляете, какой был бы результат, если для постановки фильма «Война и мир» С. Бондарчук использовал бы краткий пересказ одноименного произведения Л. Толстого…?
Публичное обсуждение этих документов проходило в сентябре – ноябре 2015 г. Отдельный интерес заслуживают отрицательные отзывы Министерства Экономического Развития и Торговли (МЭРТ). Наибольшее количество негативных комментариев было дано в отношении требований, формулировки которых не дают прямых указаний на то, каким образом эти требования должны быть выполнены. Несколько примеров. В проекте правил надлежащей дистрибьюторской практики, подготовленном МЗ РФ, система качества была определена как «совокупность всех элементов системы, направленной на внедрение политики в области качества и обеспечения достижения целей в области качества, а также деятельность, направленная на создание уверенности, что требования к качеству будут выполнены». На что эксперты МЭРТ заметили, что «остается неясным, какая деятельность, может быть оценена как «направленная на создание уверенности, что требования к качеству будут выполнены», на основании каких критериев и данных может быть сделан соответствующий вывод».
Другой пример. В соответствии с пунктом 29 проекта правил надлежащего хранения субъектом обращения лекарственных средств «должны быть приняты меры, обеспечивающие разделение потоков движения лекарственных препаратов для медицинского применения на складе субъекта обращения лекарственных средств». По мнению МЭРТ «остается неясным, какое движение лекарственных средств может быть признано «обеспечивающим разделение потоков», а также на основании каких данных могут быть сделаны соответствующие выводы. Кроме того, не ясно, в каких целях необходимо установить на складе субъекта обращения лекарственных средств проектируемое разграничение».
Указанные комментарии очень отчетливо отражают неготовность экспертного сообщества воспринимать неявно сформулированные требования, требующие от представителей индустрии детального анализа этих требований и обоснования мер, направленных на их выполнение. И дело здесь не только в возможном незнании МЭРТ специфики правил GxP. Аналогичная ситуация характерна и для участников рынка, о чем свидетельствуют результаты многочисленных ежегодных аудитов субъектов обращения лекарственных средств, в которых автор участвует на регулярной основе. Гораздо привычней для отечественной фармацевтической индустрии является ситуация, когда регулятор самостоятельно решает, что хорошо, что плохо, на каком расстоянии от входа нужно повесить устройство для измерения температуры и влажности, например. Хотя при этом и не учитывается специфика конкретного склада, профиль температур, необходимость и достаточность предпринимаемых мер по обеспечению качества лекарственных средств в условиях конкретной логистической цепочки.
Несмотря на отрицательный отзыв МЭРТ Правила надлежащей практики хранения и транспортировки, хотя и в урезанном виде по сравнению с документом, проходившим общественное обсуждение в конце 2015 г., были утверждены. Изначально присущие документу недостатки, о чем говорилось выше, усилились из-за того, что проект Правил надлежащей дистрибьюторской практики опубликован не был. А именно в этом документе вводился понятийный аппарат, который используется в утвержденных Приказом 646н Правилах. Кроме того, в проекте Правил надлежащей дистрибьюторской практики гораздо более развернуто были даны требования к системе менеджмента качества, которая является центральным элементом любой надлежащей практики GxP. Ведь именно система менеджмента качества является «опорно-двигательным аппаратом» организации, включая в себя управление бизнеспроцессами, контроль качества продукции, систему корректирующих и предупреждающих действий, управление изменениями, анализ со стороны руководства, базируясь на эффективном управлении рисками и знаниями. Более подробно данная концепция изложена в руководстве ICH Q105.
К другим недостаткам Приказа 646н можно отнести ряд смысловых неточностей, которые остались почему-то незамеченными в процессе утверждения. Например, п. 23 Правил ошибочно предписывает регистрировать результаты картирования ежедневно, в том числе и в выходные дни. Очевидно, что в данном случае речь идет о температурном мониторинге. Далее в п. 59 говорится о том, что «в процессе перевозки лекарственных препаратов должна обеспечиваться возможность подтверждения качества, подлинности и целостности лекарственных препаратов». Какая связь перевозки с возможностью подтверждения качества? Ясно, что никакой. Скорей всего имелось в виду, что перевозка не должна оказывать негативного воздействия на качество препаратов.
Кроме стилистических огрехов Приказ 646н интересен возникшими с его появлением юридическими коллизиями. Как известно фармацевтическая деятельность, к которой относится хранение и транспортировка лекарственных препаратов, является лицензируемым видом деятельности. Требования к лицензиатам установлены Постановлением Правительства РФ 1081 от 22.12.2011 «Положение о лицензировании фармацевтической деятельности». Т.к. на момент выхода Приказа 646н в Постановление №1081 изменения не вносились, то требования Приказа 646н де-юре не относятся к лицензионным требованиям. Вместе с этим никто не отменял приказы 706н и 1222н, требования которых в части хранения лекарственных препаратов частично повторяются в Приказе 646н. При этом именно на Приказ 1222н ссылается Постановление Правительства РФ 1081 в части лицензионных требований к хранению лекарственных препаратов организациями оптовой торговли.
Другим заслуживающим внимания аспектом Приказа 646н является передача деятельности по хранению и перевозке лекарственных препаратов на аутсорсинг. Однако, пункт 4.а Постановления Правительства РФ 1081 указывает на то, что соискатель лицензии для осуществления фармацевтической деятельности должен иметь в наличии помещения и оборудование, «принадлежащих ему на праве собственности или на ином законном основании, необходимых для выполнения работ (услуг), которые составляют фармацевтическую деятельность, соответствующих установленным требованиям».
Согласно п. 23.1 приказа 706н «площадь складских помещений должна соответствовать объему хранимых лекарственных средств, но составлять не менее 150 кв. м». Аналогичное требование есть и в п 13 приказа 646н: площадь помещений, используемых производителями лекарственных препаратов и организациями оптовой торговли лекарственными препаратами, должна соответствовать объему хранимых лекарственных препаратов и составлять не менее 150 кв. м. Т.е. несмотря на то, что деятельность по хранению может быть полностью передана на аутсорсинг, существующие лицензионные требования однозначно не указывают на то, что в этом случае лицензиат освобождается от необходимости располагать помещением площадью 150 кв. м.
В завершении отметим еще одну сложность, связанную с приказом 646н. До его появления обязанность субъектов обращения лекарственных средств осуществлять температурный мониторинг условий транспортировки фактически отсутствовала. Единственной группой лекарственных препаратов, для которых такие требования были установлены – это вакцины. В п. 64 приказа 646н говорится о том, что оборудование, которое используется для контроля и поддержания температурного режима подлежит поверке и (или) калибровке в соответствии с 102-ФЗ «Об обеспечении единства измерений». Согласно ст. 13 п.1 102-ФЗ средства измерений, предназначенные для применения в сфере государственного регулирования обеспечения единства измерений, к которой относится в частности здравоохранение, до ввода в эксплуатацию, а также после ремонта подлежат первичной поверке, а в процессе эксплуатации – периодической поверке. Поверка возможна только в том случае, если средство измерений внесено в государственный реестр средств измерений.
Сегодня в госреестре средств измерений практически нет устройств, которые используются для мониторинга и управления температурой в процессе транспортировки. Проведение калибровки осуществляется на добровольных началах. Таким образом, приказ 646н фактически уровнял легитимность мероприятий по поверке и калибровке, что не вполне соответствует требованиям 102-ФЗ.
Однозначно допустимость проведения только калибровки без поверки может существенно упростить жизнь игрокам рынка. Ведь наиболее распространенные устройства для температурного мониторинга, например, логгеры и индикаторы производства компаний Sensitech, Elpro, Berlinger, LogTag не внесены в госреестр средств измерений, а значит, на них невозможно получить сертификат о поверке, не говоря уже о самописцах, установленных в кузовах рефрижераторов, оборудованных установками Carrier или Thermo King. Интересно, что сегодня термоиндикаторы и терморегистраторы можно обнаружить не в реестре средств измерений, а государственном реестре медицинских изделий, т.к. данные устройства странным образом классифицируются в РФ как изделия медицинского назначения.
С другой стороны непонятно будут ли признаваться регулятором сертификаты калибровки, выданные производителем или метрологическим институтом, находящимися не на территории РФ? Напомню, что РФ является одним из подписантов Соглашения о взаимном признании национальных эталонов и сертификатов калибровки и измерений, выдаваемых национальными метрологическими институтами. Поэтому, если сертификаты калибровки оформлены в соответствии с требованиями национальных метрологических институтов, авторизованных в рамках данного Соглашения, то такие сертификаты должны иметь законную силу на территории РФ.
Заканчивая обзор нормативноправовой базы, хотелось бы сказать несколько слов о Правилах надлежащей дистрибьюторской практики, утвержденных Решением Совета Евразийской экономической комиссии от 03.11.2016 №80. С уверенностью можно утверждать, что документ, подготовленный Евразийской комиссией, является наиболее приближенным к Европейским правилам надлежащей дистрибьюторской практики, хотя и здесь не обошлось без «трудностей перевода»:
Из раздела 1.1, описывающего принципы менеджмента качества, было убрано указание на то, что Система качества является прямой ответственностью высшего руководства организации и требует демонстрации лидерства и активного участия, а также поддержки со стороны персонала. Трудно объяснить, чем руководствовались эксперты, решив убрать акцент на ответственность руководства за функционирование системы менеджмента качества. Вместе с тем, хорошо известно, что в тех организациях, где руководство имеет весьма отдаленное представление о том, что собой представляет система менеджмента качества, внедрение принципов и правил надлежащих практик крайне затруднено. Не зря в руководствах для инспекторов FDA (Food Drug Administration) предлагается начинать анализ функционирования системы менеджмента качества с выполнения руководством своих обязанностей.
Из раздела 1.15 исчезла ссылка на руководство ICH Q9 по управлению рисками в области качества.
В отличие от приказа 646н Евразийские правила надлежащей дистрибьюторской практики требуют, чтобы измерительные устройства поверялись и калибровались (См. раздел 3.3 п. 41 и 9.2 п. 127). Как обсуждалось выше, выполнение этого требования может быть весьма затруднительным, если вообще возможно.
Совершенно неожиданно в разделе 3.3.2 необходимость осуществления корректирующих и предупреждающих действий предлагается определять на основе статистического прогнозирования с применением Байесовских моделей прогнозирования. Почему именно Байесовских? Действительно ли всегда нужно использовать методы статистического прогнозирования для принятия решения об инициировании САРА по итогам квалификации? Нам представляется, что подобные рекомендации являются избыточными, далеко не всегда реализуемые на практике.
По тексту документа английский глагол «to control» переведен на русский язык как «контролировать». Прямой перевод с использованием созвучного русского эквивалента в данном случае является не самым удачным. Дело в том, что английский глагол «to control» обозначает, в частности, оказание управляющего воздействия на объект. И тогда словосочетание «equipment used to control or to monitor the environment» правильней переводить как «оборудование, используемое для поддержания или мониторинга параметров [температура, влажность] окружающей среды». На сегодня в РФ, насколько мне известно, оборудование, используемое для обеспечения температурного режима, т.е. системы «управляющий измерительный модуль-датчики», практически никто не калибрует и тем более не поверяет. Вместе с тем, начиная с 2013 г. Европейские правила надлежащей дистрибьюторской практики требуют калибровать как управляющее измерительное оборудование, так и оборудование, используемое для мониторинга.
Интересно отметить, что когда в Европе готовились к вступлению в 2013 г. новых правил надлежащей дистрибьюторской практики, на протяжении двух лет, пока шло обсуждение документа, были организованы десятки конференций, посвященных новым регуляторным требованиям, в которых участвовали и представители индустрии, и представители регуляторного сообщества. Участники конференций активно обсуждали, как именно интерпретировать те или иные аспекты правил надлежащей дистрибьюторской практики. Не пропадает интерес к этой тематике до сих пор, спустя почти четыре года с момента их внедрения. Интересно, как будут развиваться события у нас? Очень хотелось бы иметь возможность обсудить все те вопросы, которые подняты в этом разделе, но вряд ли получится. Ведь уже с 1 марта мы начинаем жить по-новому… Более того, по информации от участников рынка, уже начиная с конца прошлого года при проведении лицензионных проверок инспектора Росздравнадзора активно используют восьмистраничный опросный лист, в который включены аспекты проведения картирования складских помещений, элементы системы сохранности данных (data integrity), проведения квалификации транспортных средств.
В зависимости от результатов проверки по данному опросному листу соискатель лицензии признается соответствующим или несоответствующим лицензионным требованиям, указанным в Постановлении Правительства 1081. Вот уж действительно теория относительности в действии: где-то 1 марта 2017 г. наступило чуть раньше.
Основные недостатки выявляемые в ходе GDP аудитов складских провайдеров и транспортных компаний на территории РФ
При таком огромном количестве организаций, занимающихся дистрибьюцией лекарственных препаратов, какое существует в России, любая оценка соответствия или несоответствия рынка нормативным документам, обсуждаемым в данной статье, будет заведомо неточной. В то же время некоторые явные тенденции существуют, и о них пойдет речь.
Основываясь на результатах аудитов, в которых мне довелось участвовать в течение 2013-2016 гг., как в России, так и за ее пределами, а также данных, любезно предоставленных коллегами по цеху (в общей сложности 105 аудитов), можно утверждать, что категориями, в отношении которых наиболее часто инициируют несоответствия, являются:
- Система менеджмента качества
- Помещения и оборудование
- Управление складскими запасами.
Эти результаты хорошо согласуются с относительно свежими данными Медицинского Агентства Великобритании (MHRA), озвученные на GDP/GMP Симпозиуме, организованного Агентством и прошедшим в декабре, 2016 г.
Более подробная информация по каждой из категорий приведена в таблицах в порядке убывания частоты инициирования:
Таблица 1. Система менеджмента качества
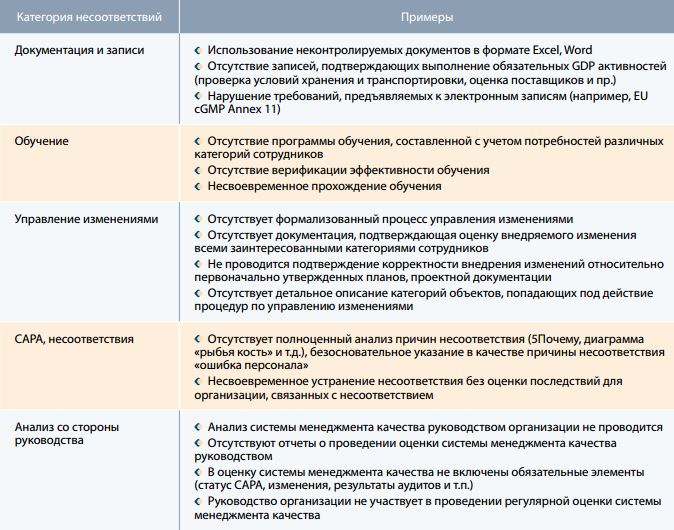
Таблица 2. Помещения и оборудование
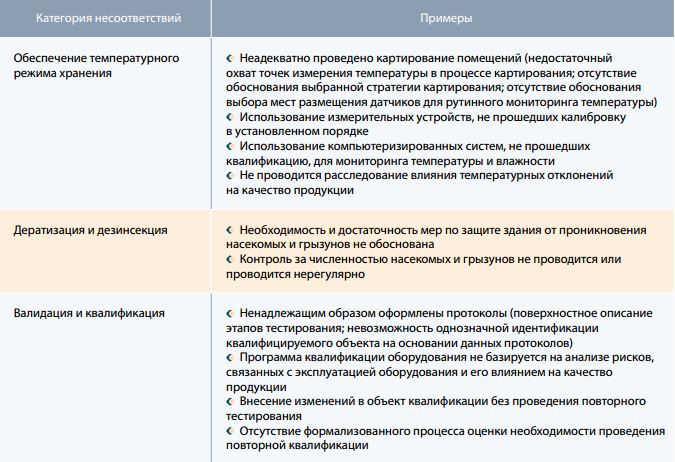
Таблица 3. Управление складскими запасами

Безусловно, ряд выявляемых нарушений, которые относятся к техническим аспектам организации процессов хранения и транспортировки, например, картирование складских помещений, валидация, связаны с недостатком экспертизы индустрии, имеющейся в российской фармацевтической логистике т.к. до не давнего времени уровень нормативных требований, предъявляемых к организациям оптовой и розничной торговли лекарственными препаратами, был крайне низким, поэтому существенного стимула ориентироваться на лучший мировой опыт не было.
Справедливости ради отметим, что крупнейшие фармдистрибьюторы и складские провайдеры выгодно отличаются от остальных участников рынка в плане наличия необходимых компетенций. Наверное, не последнюю роль в этом сыграли зарубежные фармацевтические компании, которые, ориентируясь на международные стандарты, транслировали эти требования своим партнерам посредством соглашений по качеству и проведения регулярных аудитов. Но таких компаний единицы, а как быть с остальными сотнями и тысячами организаций?
Но даже крупные игроки рынка, не говоря о компаниях с гораздо меньшим оборотом, испытывают трудности с полноценным внедрением основных элементов фармацевтической системы качества, таких как управление рисками, изменениями, работа с несоответствиями и САРА и др. Полагаю, что основная причина связана с недостаточным пониманием руководителей тех возможностей, которые возникают на фоне внедрения полноценной системы менеджмента качества. А без заинтересованности руководства организации система менеджмента качества обречена существовать в параллельном мире, к сожалению часто очень далеком от реальной жизни компании.
Отдельная и весьма существенная проблема, с которой приходится сталкиваться участникам рынка, относится к транспортировке лекарственных препаратов. Первая, и возможно главная трудность, заключается в том, что даже у лидеров транспортного рынка количество собственных транспортных средств крайне ограничено. Это определяет необходимость привлечения субподрядчиков. И если даже удается найти подрядчика, который увлечен внедрением надлежащих дистрибьюторских практик, то на уровне его субподрядчиков говорить об организациях, которые хотя бы отдаленно соответствуют правилам надлежащей дистрибьюторской практики, не приходится.
Интересен в этом отношении опыт общения с крупными международными логистическими операторами, которые присутствуют на российском рынке. Эти организации, как правило, вообще не располагают собственным транспортом и выполняют роль процессингового центра, осуществляющего управление процессом доставки груза. Имея за плечами обширный опыт в использовании ИТ-технологий для обработки заказов, выстраивания оптимальной финансовой модели транспортной логистики, позволяющей предложить клиентам конкурентную стоимость услуг, данные организации не имеют опыта организации именно фармацевтической логистики: как правило, среди критериев отбора субподрядчиков наличие опыта работы в соответствии с принципами надлежащей практики дистрибьюции или эффективно функционирующей системы менеджмента качества отсутствуют. Обсуждая проблему перевозки лекарственных препаратов с руководителем отдела продаж одной из международной логистической компании, я был крайне удивлен, когда на вопрос об имеющемся в российском представительстве опыте перевозки лекарственных препаратов, получил ответ, что в организации не видят разницу между перевозкой огурцов, например, и лекарств, т.к. принципы организации транспортировки одни и те же… Хочется верить, что со временем подобные взгляды уйдут в прошлое.
Другая проблема, связанная с транспортной логистикой, – это безопасность перевозок. Официальная статистика по данному вопросу практически отсутствует. В СМИ за последние несколько лет просочилась информация всего о нескольких случаях кражи лекарственных препаратов:
- Февраль, 2015 г., Климовск, Моск.обл., общая стоимость $253 000
- Октябрь, 2015 г., Санкт-Петербург, общая стоимость $495 360
- Январь, 2017 г., Москва, общая стоимость $187 000
Однако, по мнению экспертов, ежегодно опрашиваемых агентствами FreightWatch и ТАРА, безопасность перевозок в России на весьма низком уровне, сравнимым с транспортной безопасностью в таких странах, как Индия, Бразилия и Мексика.
В связи с серьезными репутационными рисками, бюрократическими проволочками и отсутствием надежды на успех в расследовании преступления потерпевшие компании предпочитают не сообщать о случаях кражи лекарственных препаратов в полицию. При этом, по мнению экспертов общее количество краж в сфере дистрибьюции лекарственных препаратов составляет до нескольких процентных пунктов от общего числа обычных краж.
Таким образом, вопросам безопасности при доставке лекарственных препаратов нужно уделять первостепенное значение, препятствуя нелегальному обороту лекарственных средств, наряду с внедрением других элементов надлежащей дистрибьюторской практики, применимых к транспортировке.
Заключение
Если посмотреть на историю внедрения GMP и GDP в других странах, то становится очевидным, что лучшие мировые практики приживались под давлением регуляторных органов, которые поднимали планку, заставляя игроков рынка ориентироваться на более высокие стандарты ведения бизнеса. Хрестоматийным примером, иллюстрирующим данный тезис, является история появления в США в 1906 г. закона об обороте пищевой и медицинской продукции (Food & Drug Act), сыгравшим ключевую роль в формировании Департамента по контролю за оборотом пищевой и медицинской продукции (Food & Drug Administration, FDA).
Будем надеяться, что курс на внедрение надлежащих практик, взятый российскими законодателями, получит свое полноценное развитие. При этом переход на новые стандарты ведения фармацевтического бизнеса будет осуществляться в постоянном диалоге индустрии и законодательных и контролирующих органов.
Источник: gmpnews.ru
19.10.2024
Южнокорейская HAEAHN разработала мастер-план медкластера в Новом Ташкенте стоимостью $500 млн
Компания из Южной Кореи HAEAHN Architecture разработала мастер-план медицинского кластера на 420 га в...
18.10.2024
Видеоинтервью: Медицина как бизнес, самодиагностика и самолечение
Мы всегда знаем, какой врач нам нужен, хотя к узким специалистам пациентов направляет терапевт. Но мало...
18.10.2024
Дети с инвалидностью будут учиться в юридических техникумах бесплатно
Принято постановление Кабинета Министров Республики Узбекистан «О внесении изменений и дополнений в некоторые...






