11.04.2018
В соответствии с постановлением Президента Республики Узбекистан от 14 февраля 2017 года № ПП-2773 «О мерах по дальнейшему совершенствованию порядка реализации лекарственных средств и изделий медицинского назначения, лицензирования фармацевтической деятельности» Кабинет Министров постановляет:
1. Утвердить:
Положение о порядке лицензирования розничной реализации лекарственных средств и изделий медицинского назначения согласно приложению № 1;
Положение о территориальной комиссии по лицензированию розничной реализации лекарственных средств и изделий медицинского назначения согласно приложению № 2;
Типовой состав территориальной комиссии по лицензированию розничной реализации лекарственных средств и изделий медицинского назначения согласно приложению № 3;
Положение о порядке лицензирования фармацевтической деятельности, кроме розничной реализации лекарственных средств и изделий медицинского назначения согласно приложению № 4;
Схему электронного информационного взаимодействия при лицензировании фармацевтической деятельности согласно приложению № 5.
2. Определить, что:
ранее выданные Министерством здравоохранения Республики Узбекистан лицензии на право осуществления розничной реализации лекарственных средств и изделий медицинского назначения действуют до истечения срока их действия;
лицензии на право осуществления розничной реализации лекарственных средств и изделий медицинского назначения выдаются отдельно от лицензий на право осуществления других направлений фармацевтической деятельности и действуют на всей территории Республики Узбекистан.
3. Совету Министров Республики Каракалпакстан, хокимиятам областей и города Ташкента обеспечить:
в срок до 15 мая 2017 года образование территориальных комиссий по лицензированию розничной реализации лекарственных средств и изделий медицинского назначения (далее — территориальные комиссии), а также реализацию мер по организации их деятельности;
координацию деятельности территориальных комиссий и соответственно их рабочих органов — Министерства здравоохранения Республики Каракалпакстан, территориальных управлений здравоохранения и главного управления здравоохранения города Ташкента.
4. Министерству здравоохранения Республики Узбекистан:
в двухнедельный срок совместно с Министерством по развитию информационных технологий и коммуникаций Республики Узбекистан и другими заинтересованными министерствами и ведомствами внести в Кабинет Министров Республики Узбекистан предложения по разработке и внедрению базы данных реестров адресов и реестров работников аптек и филиалов, действие лицензии которых было прекращено вследствие выявленных нарушений законодательства, в том числе за грубое нарушение порядка ценообразования лекарственных средств и изделий медицинского назначения, а также по определению источников покрытия расходов для реализации указанных работ;
в месячный срок совместно с заинтересованными министерствами и ведомствами привести принятые ими нормативно-правовые акты и нормативные документы в области технического регулирования в соответствие с настоящим постановлением.
5. В Перечне лицензирующих органов, осуществляющих лицензирование отдельных видов деятельности, утвержденном постановлением Кабинета Министров от 28 июня 2002 г. № 236 (СП Республики Узбекистан, 2002 г., № 6, ст. 36):
а) абзац третий раздела «Министерство здравоохранения Республики Узбекистан» изложить в следующей редакции:
«Фармацевтическая деятельность (кроме розничной реализации лекарственных средств и изделий медицинского назначения)»;
б) раздел «Совет Министров Республики Каракалпакстан, хокимияты областей и г. Ташкента» дополнить абзацем следующего содержания:
«Розничная реализация лекарственных средств и изделий медицинского назначения».
6. Признать утратившими силу некоторые постановления Кабинета Министров Республики Узбекистан согласно приложению № 6.
7. Контроль за исполнением настоящего постановления возложить на министра здравоохранения Республики Узбекистан А.К Шадманова и Информационно — аналитический департамент по вопросам здравоохранения, экологии, охраны окружающей среды, физической культуры и спорта Кабинета Министров Республики Узбекистан.
Премьер-министр Республики Узбекистан А. АРИПОВ
г. Ташкент,
12 мая 2017 г.,
№ 284
ПРИЛОЖЕНИЕ № 1
к постановлению Кабинета Министров
от 12 мая 2017 года № 284
ПОЛОЖЕНИЕ
о порядке лицензирования розничной реализации лекарственных средств и изделий медицинского назначения
Глава 1. Общие положения
1. Настоящее Положение определяет порядок лицензирования розничной реализации лекарственных средств и изделий медицинского назначения.
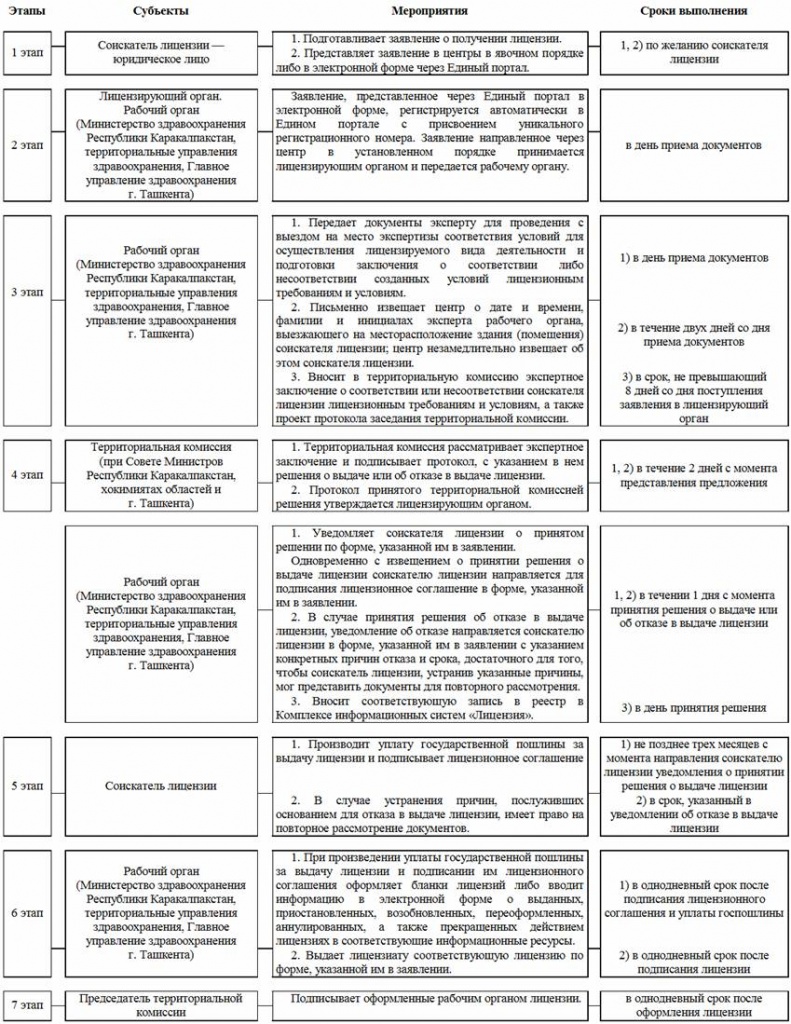
2. Лицензирование розничной реализации лекарственных средств и изделий медицинского назначения осуществляется Советом Министров Республики Каракалпакстан, хокимиятами областей и города Ташкента (далее — лицензирующий орган) по месту государственной регистрации соискателя лицензии.
Лицензирование розничной реализации лекарственных средств и изделий медицинского назначения осуществляется по схеме согласно приложению № 1 к настоящему Положению.
3. Лицензирование розничной реализации лекарственных средств и изделий медицинского назначения осуществляется через Центры государственных услуг (далее — центры) либо через Единый портал интерактивных государственных услуг Республики Узбекистан (далее — Единый портал).
(пункт 3 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
4. Розничная реализация лекарственных средств и изделий медицинского назначения осуществляется только аптеками и их филиалами.
5. На осуществление розничной реализации лекарственных средств и изделий медицинского назначения выдаются типовые (простые) лицензии.
6. Лицензия на осуществление розничной реализации лекарственных средств и изделий медицинского назначения (далее — лицензии) выдается сроком на пять лет.
Лицензия может быть выдана на срок менее пяти лет только по заявлению соискателя лицензии.
7. Получение лицензии на осуществление розничной реализации лекарственных средств и изделий медицинского назначения не ограничивает право получения лицензии на другие части фармацевтической деятельности.
Передача лицензии или прав по ней другим лицам запрещается.
Глава 2. Лицензионные требования и условия
8. Лицензионными требованиями и условиями при осуществлении розничной реализации лекарственных средств и изделий медицинского назначения являются:
а) обязательное соблюдение законодательства о лекарственных средствах и фармацевтической деятельности, а также требований нормативных документов в области технического регулирования в сфере обращения лекарственных средств и изделий медицинского назначения;
б) наличие в штате юридического лица не менее одного работника –заведующего аптекой, имеющего высшее фармацевтическое образование, и не включенноых в реестр работников аптек, действие лицензии которых было прекращено вследствие выявленных нарушений законодательства (далее — реестр работников), в том числе за грубое нарушение порядка ценообразования лекарственных средств и изделий медицинского назначения;
в) при открытии лицензиатом филиала аптеки — наличие в штате юридического лица не менее одного работника — заведующего филиалом аптеки, имеющего высшее фармацевтическое образование или среднее специальное профессиональное образование со специальностью ассистент (помощник) фармацевта;
г) формирование персонала аптеки, филиала аптеки из числа лиц, не включенных в реестр работников;
д) повышение квалификации заведующего аптекой и/или заведующего филиалом аптеки в установленном порядке;
е) наличие на праве собственности или ином вещном праве здания (помещения), соответствующего требованиям, предусмотренным в приложении № 2 к настоящему Положению, для осуществления розничной реализации лекарственных средств и изделий медицинского назначения, и не включенных в реестр адресов аптек и филиалов, действие лицензии которых было прекращено вследствие выявленных нарушений законодательства (далее — реестр адресов), в том числе за грубое нарушение порядка ценообразования лекарственных средств и изделий медицинского назначения;
ж) наличие материально — технической базы, соответствующей требованиям, предусмотренным в приложении № 2 к настоящему Положению;
з) письменное уведомление лицензирующего органа об изменении заведующего аптекой, заведующего филиалом аптеки, закрытии филиала аптеки, составленное по форме, согласно приложению № 3 к настоящему Положению, в течении десяти дней с даты наступления указанных случаев;
и) уплата сборов, государственных пошлин в случаях, сроках и размерах, установленных настоящим Положением.
Глава 3. Документы, необходимые для получения лицензии
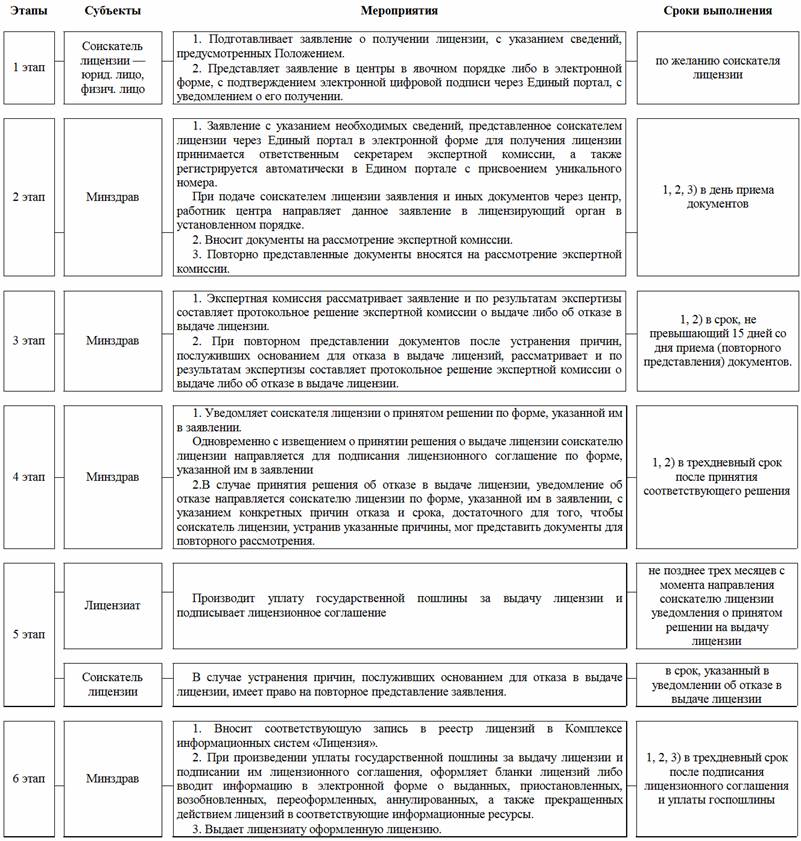
9. Для получения лицензии соискатель лицензии представляет в центр в явочном порядке или в электронном виде через Единый портал следующие документы:
(абзац первый пункта 9 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
заявление о выдаче лицензии по форме согласно приложению № 4 к настоящему Положению (далее — заявление);
сведения, подтверждающие уплату сбора за рассмотрение заявления о выдаче лицензии.
Указание в заявлении о выдаче лицензии электронного адреса соискателя лицензии является его согласием на получение уведомления о принятом решении по его заявлению в электронной форме через Единый портал.
10. Требование от соискателя лицензии представления документов и сведений, не предусмотренных пунктом 9 настоящего Положения, не допускается.
11. Рабочим органом соответствующей территориальной комиссии является Министерство здравоохранения Республики Каракалпакстан, территориальные управления здравоохранения, Главное управление здравоохранения города Ташкента (далее — рабочий орган).
Рабочий орган самостоятельно получает необходимые для выдачи лицензии документы и информацию, имеющиеся в других уполномоченных органах в установленном порядке в соответствии со схемой электронного информационного взаимодействия при лицензировании фармацевтической деятельности, определенной Кабинетом Министров Республики Узбекистан
12. При обращении в явочном порядке работник центра проверяет полноту заполнения заявления в соответствии с паспортом государственной услуги, утвержденным лицензирующим органом в установленном порядке.
После регистрации заявления, работник центра выдает соискателю лицензии расписку о получении заявления или проставляет соответствующую отметку на копии заявления, с указанием регистрационного номера заявления.
(пункт 12 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609
13. Работник центра в день получения заявления в явочном порядке вносит сведения, указанные в заявлении, в специальную форму, которая направляется через Единый портал соответственно в лицензирующий и рабочий органы.
(пункт 13 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
14. В случае обращения в явочном порядке в центр не по месту нахождения соискателя лицензии, заявление направляется в соответствующий рабочий орган центром через Единый портал.
В случае представления соискателем лицензии в центр заявления на электронном носителе работник центра оказывает ему, при необходимости, содействие в направлении заявления через Единый портал в помещении центра, отведенном для самообслуживания.
(пункт 14 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
15. Заявление, направленное через Единый портал, регистрируется автоматически с присвоением уникального регистрационного номера.
Глава 4. Рассмотрение заявления и принятие решения о выдаче лицензии или об отказе в выдаче лицензии
16. За рассмотрение заявления о выдаче лицензии с соискателя лицензии взимается сбор в размере двух минимальных заработных плат, установленным законодательством на день подачи заявления. В случае представления заявления о выдаче лицензии одновременно с открытием филиала аптек, установленный сбор взимается за каждый открываемый филиал.
17. В случае подачи заявления о выдаче лицензии соискателем лицензии через Единый портал, средства в размере 20 процентов от суммы сбора за рассмотрение заявления зачисляются на лицевой счет внебюджетного фонда Агентства государственных услуг при Министерстве юстиции Республики Узбекистан, а оставшаяся часть средств зачисляется на счет лицензирующего органа.
(абзац первый пункта 17 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
В случае обращения в явочном порядке в центры, средства в размере 20 процентов от суммы уплачиваемых сборов за рассмотрение заявлений зачисляются на лицевой счет внебюджетного фонда Агентства государственных услуг при Министерстве юстиции Республики Узбекистан в установленном порядке.
(абзац второй пункта 17 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
В случае отказа соискателя лицензии от поданного заявления сумма уплаченного сбора возврату не подлежит.
18. Решение о выдаче или об отказе в выдаче лицензии принимается в срок, не превышающий пятнадцати дней со дня получения заявления соискателя лицензии.
19. Для рассмотрения документов о выдаче лицензии, подготовки заключений по ним в лицензирующем органе создается территориальная комиссия по лицензированию розничной реализации лекарственных средств и изделий медицинского назначения (далее — территориальная комиссия).
Положение о территориальной комиссии и ее типовой состав определяются Кабинетом Министров Республики Узбекистан.
20. Рабочий орган с даты представления заявления в центр:
(абзац первый пункта 20 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
в течение двух дней обязан письменно известить центр посредством Единого портала о дате и времени, фамилии и инициалах уполномоченного представителя рабочего органа, выезжающего на местонахождение соискателя лицензии, для изучения соискателя лицензии на соответствие лицензионным требованиям и условиям по форме, согласно приложению № 5 к настоящему Положению. При этом работник центра незамедлительно извещает соискателя лицензии о дате и времени проведения изучения, а также уполномоченном представителе рабочего органа;
(абзац второй пункта 20 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
в течение семи дней рассматривает представленные документы и обеспечивает своевременный выезд на местонахождения соискателя лицензии, уполномоченного представителя, который обязан представить свое служебное удостоверение соискателю лицензии с разъяснением ему порядка проведения изучения на соответствие лицензионным требованиям и условиям. Уполномоченный представитель обязан завершить изучение в течение одного рабочего дня;
в течение десяти дней вносит в территориальную комиссию заключение об изучении соискателя лицензии на соответствие лицензионным требованиям, с указанием о соответствии или не соответствии соискателя лицензии лицензионным требованиям и условиям, установленным пунктом 8 настоящего Положения, а также проект протокола заседания территориальной комиссии.
В качестве уполномоченных представителей должны быть привлечены высококвалифицированные специалисты соответствующего профиля и специалисты органов санитарно-эпидемиологического надзора.
Территориальная комиссия обеспечивает соблюдение рабочим органом сроков, предусмотренных настоящим пунктом.
21. Лицензирующий орган вправе привлекать на договорной основе уполномоченного представителя рабочего органа для рассмотрения представленных соискателем лицензии документов.
22. Территориальная комиссия рассматривает заключение рабочего органа и вносит подписанный протокол в лицензирующий орган в течение двух рабочих дней со дня представления заключения рабочего органа.
23. Лицензирующий орган в день подписания территориальной комиссией протокола утверждает его, с указанием в нем решения о выдаче или об отказе в выдаче лицензии.
Утвержденный территориальной комиссией протокол является решением лицензирующего органа о выдаче или об отказе в выдаче лицензии.
24. Территориальная комиссия в течение двух рабочих дней с даты принятия лицензирующим органом решения о выдаче либо об отказе в выдаче лицензии направляет через Единый портал уведомление о принятом решении в:
центр для последующего его направления (вручения) соискателю лицензии в установленном порядке;
(абзац второй пункта 24 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
соответствующий рабочий орган для ведения соответствующего учета.
25. Уведомление:
о принятом решении о выдаче лицензии должно содержать реквизиты банковского счета и срок оплаты государственной пошлины за выдачу лицензии;
об отказе в выдаче лицензии должно содержать причины отказа, конкретные нормы законодательства и срок, в течение которого соискатель лицензии, устранив указанные причины, может представить документы для повторного рассмотрения.
Срок, в течение которого соискатель лицензии вправе устранить причины отказа и представить документы для повторного рассмотрения, должен быть соразмерным времени, необходимому для устранения причин отказа.
26. Лицензии оформляются рабочим органом, подписываются руководителем лицензирующего органа, в случае его отсутствия его заместителем, и выдаются в установленном порядке в трехдневный срок после представления соискателем лицензии документа, подтверждающего оплату государственной пошлины.
При подтверждении соискателем лицензии о соблюдении лицензионных требований и условий путем проставления всех отметок в разделе XI приложения № 4 к настоящему Положению, подписание лицензионного соглашения не требуется.
27. Лицензии оформляются на специальных бланках.
Образец бланка лицензии утверждается лицензирующим органом согласно типовой форме бланка лицензии, предусмотренной приложением № 6 к настоящему Положению.
Бланки лицензий являются документами строгой отчетности, имеют учетную серию, номер и степень защищенности. Бланки лицензий изготавливаются по заказу лицензирующего органа типографским способом в ГПО «Давлат белгиси». Руководитель лицензирующего органа несет ответственность за учет, сохранность и целевое использование бланков лицензий, а также за достоверное и своевременное внесение информации о выданных, приостановленных, возобновленных, переоформленных, аннулированных, а также прекращенных действием лицензиях в соответствующие информационные ресурсы.
28. В случае, если лицензиат в течение трех месяцев с момента направления (вручения) уведомления о принятии решения о выдаче лицензии не произвел уплату государственной пошлины, лицензирующий орган вправе принять решение об аннулировании лицензии.
29. В выдаче лицензии может быть отказано по основаниям, установленным статьей 17 Закона Республики Узбекистан «О лицензировании отдельных видов деятельности».
Соискатель лицензии имеет право обжаловать решение лицензирующего органа об отказе в выдаче лицензии, а также действие (бездействие) должностного лица лицензирующего органа в порядке, установленном законодательством.
30. В случае устранения соискателем лицензии причин, послуживших основанием для отказа в выдаче лицензии в установленный срок, повторное рассмотрение документов, выдача лицензии или отказ в ее выдаче осуществляются лицензирующим органом в срок, не превышающий десяти дней со дня получения заявления соискателя лицензии об устранении причин отказа и соответствующих документов, удостоверяющих устранение причин отказа. За повторное рассмотрение заявления соискателя лицензии сбор не взимается.
При повторном рассмотрении заявления соискателя лицензии не допускается отказ в выдаче лицензии по новым основаниям, ранее не указанным в уведомлении об отказе в выдаче лицензии.
Заявление, поданное соискателем лицензии по истечении срока, указанного в уведомлении об отказе в выдаче лицензии, считается вновь поданным и рассматривается лицензирующим органом на общих основаниях.
Заявление соискателя лицензии об устранении причин отказа в выдаче лицензии и соответствующих документов, удостоверяющих устранение причин отказа, представляются в порядке, предусмотренном главой 3 настоящего Положения. При этом выполнение рабочим органом действий, предусмотренных в пункте 20 настоящего Положения, не должно превышать пяти дней.
31. Рабочий орган в месячный срок с даты получения уведомления об изменении заведующего аптекой, заведующего филиалом аптеки проверяет достоверность указанных в уведомлении сведений, представленных лицензиатом, и в случае соответствия их лицензионным требованиям и условиям, предусмотренным в подпунктах «в», «г», «д» и «е» пункта 8 настоящего Положения, вносит изменения в реестр лицензий.
Глава 5. Порядок открытия филиала аптеки
32. В случае открытия лицензиатом филиала аптеки для осуществления в рамках выданной лицензиату лицензии на осуществление розничной реализации лекарственных средств и изделий медицинского назначения, лицензиат обращается в лицензирующий орган с соответствующим заявлением в порядке, предусмотренным пунктом 9 настоящего Положения.
33. В случае открытия филиала аптеки для осуществления в рамках выданной лицензиату лицензии на осуществление розничной реализации лекарственных средств и изделий медицинского назначения, площадь помещения аптеки должна соответствовать санитарно-эпидемиологическим нормам, предъявляемым к аптекам, имеющим филиалы.
34. За рассмотрение заявления с лицензиата взимается сбор в размере двух минимальных заработных плат.
Сбор за рассмотрение заявления взимается в размере, кратном количеству открываемых филиалов для осуществления розничной реализации лекарственных средств и изделий медицинского назначения.
В случае подачи заявления о выдаче лицензиатом через Единый портал, средства в размере 20 процентов от суммы сбора за рассмотрение заявления зачисляются на лицевой счет внебюджетного фонда Агентства государственных услуг при Министерстве юстиции Республики Узбекистан, а оставшаяся часть средств зачисляется на счет лицензирующего органа.
(абзац третий пункта 34 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
В случае обращения в явочном порядке в центры средства в размере 20 процентов от суммы уплачиваемых сборов за рассмотрение заявлений зачисляются на лицевой счет внебюджетного фонда Агентства государственных услуг при Министерстве юстиции Республики Узбекистан в установленном порядке.
(абзац четвертый пункта 34 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
35. Рассмотрение заявления осуществляется в порядке, предусмотренном главой 4 настоящего Положения.
36. Лицензия филиалу аптеки оформляется в порядке, предусмотренном пунктом 27 настоящего Положения, с учетом следующих дополнительных требований:
указание номера лицензии, выданной лицензиату на осуществление розничной реализации лекарственных средств и изделий медицинского назначения и порядкового номера филиала через знак «тире»;
адрес филиала аптеки, в котором осуществляется розничная реализация лекарственных средств и изделий медицинского назначения.
37. Уплата государственной пошлины за выдачу лицензии аптеки филиалу не требуется.
Глава 6. Переоформление лицензии, продление срока ее действия, выдача дубликата
38. В случае преобразования лицензиата, изменения его наименования или место нахождения (почтового адреса) лицензиат или его правопреемник обязан в месячный срок после прохождения перерегистрации подать заявление о переоформлении лицензии в порядке, предусмотренном пунктом 9 настоящего Положения.
В случае слияния лицензиатов — юридических лиц, имеющих на дату государственной регистрации вновь возникшего юридического лица лицензии на осуществление одного и того же лицензируемого вида (его части) деятельности, допускается переоформление лицензии в порядке, предусмотренном пунктом 9 настоящего Положения.
В случае прекращения действия лицензии на часть (части) лицензируемого вида деятельности, лицензия подлежит переоформлению.
Лицензия, оформленная согласно пункту 27 настоящего Положения, представляется лицензиатом в центр явочно. Ответственный работник центра направляет лицензию в лицензирующий орган в трехдневный срок с даты ее получения.
(абзац четвертый пункта 38 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
Рабочий орган получает соответствующие документы, подтверждающие указанные сведения, посредством автоматизированной системы государственной регистрации и постановки на учет субъектов предпринимательства в соответствии с законодательством.
39. До переоформления лицензии лицензиат осуществляет указанную в ней деятельность на основании ранее выданной лицензии.
40. При переоформлении лицензии взимается сбор в половинном размере суммы, уплачиваемой за рассмотрение заявления соискателя лицензии о выдаче лицензии. В случае подачи заявления о переоформлении лицензии соискателем лицензии через Единый портал, средства в размере 20 процентов от суммы сбора за рассмотрение заявления зачисляются на лицевой счет внебюджетного фонда Агентства государственных услуг при Министерстве юстиции Республики Узбекистан, а оставшаяся часть средств зачисляется на счет лицензирующего органа.
В случае обращения в явочном порядке в центры, средства в размере 20 процентов от суммы уплачиваемых сборов за рассмотрение заявлений, зачисляются на лицевой счет внебюджетного фонда Агентства государственных услуг при Министерстве юстиции Республики Узбекистан в установленном порядке.
(пункт 40 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
41. Переоформление лицензии осуществляется в течение пяти дней со дня получения центром заявления о переоформлении лицензии либо уведомления через Единый портал о представлении лицензиатом соответствующего заявления в лицензирующий орган.
(пункт 41 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
42. Лицензирующий орган, рассмотрев представленное заявление о переоформлении лицензии, оформляет лицензию соответственно в порядке, предусмотренном пунктом 27 настоящего Положения.
В процессе переоформления лицензии лицензирующий орган вносит соответствующие изменения в реестр лицензий, формируемый в электронной форме.
При переоформлении лицензии срок действия ранее выданной лицензии не изменяется.
43. В случае утраты лицензии или ее порчи выдается дубликат. Для получения дубликата лицензиат обращается в центр в явочном порядке или в электронном виде через Единый портал в лицензирующий орган с заявлением и документом, подтверждающим утрату лицензии.
(абзац первый пункта 43 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
При выдаче дубликата лицензии взимается сбор в половинном размере суммы, уплачиваемой за рассмотрение заявления соискателя лицензии о выдаче лицензии.
44. Срок действия лицензии может быть продлен по заявлению лицензиата. Продление срока действия лицензии осуществляется в порядке, предусмотренном главами 2, 3 и 4 настоящего Положения.
Заявление о продлении срока действия лицензии должно быть подано согласно пункту 9 настоящего Положения не позднее двух месяцев до истечения срока действия лицензии. Продление срока действия лицензии осуществляется в порядке, предусмотренном для выдачи лицензии.
Глава 7. Контроль за соблюдением лицензионных требований и условий
45. Контроль за соблюдением лицензиатом лицензионных требований и условий осуществляется лицензирующим органом в порядке, установленном законодательством.
46. При осуществлении контроля за соблюдением лицензионных требований и условий лицензирующий орган в пределах своей компетенции имеет право:
проводить в порядке, установленном законодательством, плановые проверки соблюдения лицензиатом лицензионных требований и условий;
проводить в порядке, установленном законодательством, краткосрочные проверки соблюдения лицензиатом лицензионных требований и условий по решению специально уполномоченного органа — Республиканского совета по координации деятельности контролирующих органов — на основании обращений физических и юридических лиц о фактах нарушений законодательства;
привлекать специалистов соответствующего профиля для осуществления проверки соблюдения лицензионных требований и условий;
запрашивать и получать от лицензиата необходимую информацию по вопросам, возникающим при проведении проверок соблюдения лицензионных требований и условий;
составлять на основании результатов проверок акты (справки), с указанием конкретных нарушений лицензиатом лицензионных требований и условий;
выносить решения, обязывающие лицензиата устранить выявленные нарушения, устанавливать сроки устранения таких нарушений;
выносить решения или обращаться в суд о приостановлении, прекращении либо аннулировании лицензий в порядке, установленном законодательством;
выносить решения в установленном порядке о прекращении действия лицензий аптеки, филиала аптеки, вследствие нарушения законодательства, в том числе за грубое нарушение порядка ценообразования лекарственных средств и изделий медицинского назначения на основании материалов, представленных территориальными подразделениями Департамента по борьбе с налоговыми, валютными преступлениями и легализацией преступных доходов при Генеральной прокуратуре Республики Узбекистан по итогам проверочных закупок и контролируемых приобретений, а также материалов проверок территориальных подразделений Государственного комитета Республики Узбекистан по содействию приватизированным предприятиям и развитию конкуренции по нарушениям.
47. При проверке соблюдения лицензионных требований и условий проверяющими работниками лицензирующего органа составляется акт в двух экземплярах, один из которых передается лицензиату, второй — остается в лицензирующем органе.
Глава 8. Приостановление, прекращение действия и аннулирование лицензии
48. Приостановление, прекращение действия и аннулирование лицензии производится лицензирующим органом в случаях и порядке, предусмотренных статьями 22, 23 и 24 Закона Республики Узбекистан «О лицензировании отдельных видов деятельности».
Сведения о лицензиях, срок действия которых приостановлен либо прекращен, а также об аннулированных лицензиях вводятся лицензирующим органом в соответствующие информационные ресурсы.
49. Грубыми нарушениями лицензионных требований и условий, приводящие к прекращению в установленном порядке действия лицензии, являются:
систематические (два и более раза в течение одного года) нарушения лицензионных требований и условий, в том числе порядка ценообразования лекарственных средств и изделий медицинского назначения;
хранение и (или) реализация лекарственных средств и изделий медицинского назначения без сертификата соответствия;
хранение и (или) реализация незарегистрированных, недоброкачественных, фальсифицированных лекарственных средств и изделий медицинского назначения, незаконных копий зарегистрированных в Республике Узбекистан лекарственных средств и изделий медицинского назначения;
реализация лекарственных средств и изделий медицинского назначения лицом, не имеющим фармацевтического образования;
заведование аптекой, филиалом аптеки лицом, не имеющим соответственно высшего фармацевтического образования, фармацевтического образования;
осуществление лицензионной деятельности филиалом аптеки без лицензии.
50. Решение лицензирующего органа о приостановлении, прекращении действия или аннулирования лицензии может быть обжаловано в суде. В случае признания судом необоснованности прекращения действия лицензии, лицензирующий орган несет перед лицензиатом ответственность в размере понесенного им ущерба.
Глава 9. Реестр лицензий
51. Лицензирующий орган формирует посредством комплекса информационных систем «Лицензия» реестр лицензий.
52. В реестре лицензий должны быть указаны:
а) основные сведения о лицензиатах, включающие наименование организации и идентификационный номер налогоплательщика, организационно-правовую форму, фамилию, имя, отчество (при наличии) руководителя организации;
б) сведения о заведующем аптекой, заведующем филиалом аптеки:
фамилию, имя, отчество (при наличии);
паспортные данные (серия, номер, дата выдачи, наименование органа, выдавшего паспорт);
сведения диплома о высшем фармацевтическом образовании (серия, номер, дата выдачи, кем выдан) — для заведующего аптекой, сведения диплома о среднем специальном профессиональном образовании ассистента (помощнике) фармацевта;
наименование специальности;
в) адрес (адреса), по которому осуществляется лицензируемая деятельность, рабочий телефон, факс;
г) даты выдачи и номера лицензий;
д) сроки действия лицензий;
е) лицензируемая деятельность;
ж) основания и даты переоформления, продления срока действия, приостановления и возобновления действия лицензий;
з) основания и даты прекращения действия лицензий;
и) основания и даты аннулирования лицензий.
53. Лицензирующий орган вправе делегировать право по формированию реестра лицензий рабочему органу.
54. Информация, содержащаяся в реестре лицензий, размещается на официальном веб-сайте лицензирующего органа в комплексе информационных систем «Лицензия» и является открытой для ознакомления.
Глава 10. Реестр адресов и реестр работников
55. Лицензирующий орган формирует реестр адресов и реестр работников аптек и филиалов, действие лицензии которых было прекращено вследствие выявленных нарушений законодательства, в том числе за грубое нарушение порядка ценообразования лекарственных средств и изделий медицинского назначения.
56. Лицензирующий орган вносит в реестр адресов и реестр работников сведения об адресах и работниках аптек, филиалов аптек:
в однодневный срок с даты получения решения суда о прекращении действия лицензии вследствие выявленных нарушений законодательства, в том числе за грубое нарушение порядка ценообразования лекарственных средств и изделий медицинского назначения на основании данных акта проверки по соблюдению законодательства.
57. Реестр адресов и реестр работников являются частью реестра лицензий и содержат:
а) полное фирменное наименование юридического лица и его идентификационный номер налогоплательщика;
б) полный адрес аптеки, филиала аптеки, по которому совершено нарушение законодательства, в том числе грубое нарушение порядка ценообразования лекарственных средств и изделий медицинского назначения;
в) фамилия, имя, отчество работников аптек, филиалов аптек, нарушивших законодательство, в том числе грубо нарушивших порядок ценообразования лекарственных средств и изделий медицинского назначения;
г) номер, дата и наименование суда, принявшего решение о прекращении действия лицензии вследствие нарушения законодательства, в том числе за грубое нарушение порядка ценообразования лекарственных средств и изделий медицинского назначения.
58. Лицензирующий орган исключает из реестра адресов и реестра работников сведения, предусмотренные в пункте 55 настоящего Положения, по истечении трех лет со дня их включения.
59. Информация, содержащаяся в реестре адресов и реестре работников, является открытой для ознакомления.
Глава 11. Порядок уплаты государственной пошлины за выдачу лицензии
60. За выдачу или продление срока действия лицензии соискателем лицензии, лицензиатом уплачивается государственная пошлина в десятикратном размере минимальной заработной платы.
61. В случае подачи заявления о выдаче лицензии соискателем лицензии через Единый портал, средства в размере 20 процентов от суммы государственной пошлины зачисляются на лицевой счет внебюджетного фонда Агентства государственных услуг при Министерстве юстиции Республики Узбекистан, а оставшаяся часть средств направляется в Республиканский бюджет.
В случае обращения в явочном порядке в центры, средства в размере 20 процентов от суммы уплачиваемой государственной пошлины, зачисляются на лицевой счет внебюджетного фонда Агентства государственных услуг при Министерстве юстиции Республики Узбекистан.
(пункт 61 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
Глава 12. Заключительное положение
62. Лица виновные в нарушении требований настоящего Положения несут ответственность в соответствии с законодательством.
ПРИЛОЖЕНИЕ № 1
к Положению о порядке лицензирования
розничной реализации лекарственных
средств и изделий медицинского назначения
СХЕМА
лицензирования розничной реализации лекарственных средств и изделий медицинского назначения
(приложение № 1 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
ПРИЛОЖЕНИЕ № 2
к Положению о порядке лицензирования
розничной реализации лекарственных
средств и изделий медицинского назначения
ТРЕБОВАНИЯ
к зданию (помещению), материально-технической базе для осуществления розничной реализации лекарственных
средств и изделий медицинского назначения
I. Требования к зданию (помещению) для осуществления розничной реализации лекарственных средств и изделий медицинского назначения
1.1. Наличие здания (помещения) на праве собственности или ином вещном праве (договор аренды и прочее);
1.2. Местонахождение помещения не должно быть включено в реестр адресов аптек, действие лицензии которых было прекращено вследствие выявленных нарушений законодательства, в том числе за грубое нарушение порядка ценообразования лекарственных средств и изделий медицинского назначения.
1.3. Аптеки и их филиалы могут размещаться:
в отдельно стоящих зданиях (только на первом этаже);
в зданиях, встроенными или кооперируемыми с нежилыми помещениями и жилыми домами (только на первом этаже);
в первых этажах многоэтажных общественных зданий и жилых домов.
1.4. При размещении аптек и их филиалов на первых этажах жилых и общественных зданий они должны иметь отдельный вход для посетителей со стороны улицы и служебный со стороны двора, предназначенный для персонала, приема товара и вывоза пустой тары. Перед служебным входом целесообразно предусматривать погрузочно-разгрузочную площадку для подъезда машин, доставляющих товар.
1.5. Все помещения аптеки и филиалов аптеки должны быть функционально взаимосвязаны между собой согласно выполняемым функциям в единый изолированный от помещений другого назначения блок с отдельным входом. Складское помещение аптеки может быть размещено в цокольном помещении высотой не менее 2,4 метра.
1.6. Помещения аптеки разделяются на производственные (все помещения, задействованные на прием, изготовление, хранение и отпуск товара) и административно-бытовые (офисные помещения, бухгалтерия, гардеробная, санузел и т.д.).
1.7. Минимально необходимый состав и площадь помещений аптек и их филиалов:
|
№
|
Наименование помещений
|
Площадь аптек готовой лекарственной формы не менее (в кв.м.)
|
|
1.
|
Зал обслуживания посетителей
в том числе:
|
16
|
|
зона размещения оборудования рабочих мест персонала
|
8
|
|
зона обслуживания посетителей
|
8
|
|
Итого:
|
16
|
|
2
|
Комплектовочно-экспедиционное помещение*
|
10
|
|
3
|
Помещение для готовых лекарственных препаратов
(с холодильным оборудованием для термолябильных препаратов) и изделий медицинского назначения
|
12
|
|
4
|
Помещение для изделий медицинского назначения*
|
4
|
|
|
Итого:
|
26
|
|
5
|
Кабинет заведующего, бухгалтерия*
|
6
|
|
6
|
Подсобное помещение для хранения личных вещей, спецодежды, приема пищи
|
4
|
|
7
|
Уборная
|
2
|
|
|
Итого:
|
12
|
|
|
Всего:
|
34/54
|
* Действительно для аптек, имеющих филиалы.
1.8. Для аптек готовых лекарственных форм (ГЛФ) имеющих филиалы, общая площадь должна составлять не менее 54 кв.м., для аптек ГЛФ без филиалов или для филиалов — общая площадь должна составлять не менее 34 кв.м согласно пункту 1.7. настоящих требований.
1.9. В зданиях сельских врачебных пунктов могут размещаться филиалы аптек площадью не менее 8 кв.м.
II. Требования к помещениям и оборудованию аптек
2.1. Перед входом в аптеку должны быть оборудованы пандус шириной 1 м (в исключительных случаях допускается 0,9 м). Необходимо установление ограждений с поручнями на высоте 0,7-0,9 м, уклон пандуса не должен превышать 1:10 (ШНК 2.07,02-07, СанПиН № 0266-09, ШНК 2.08.02-09), а также приспособления для очистки обуви от грязи (решетки, скребки и т.п.). Очистка самих приспособлений должна проводиться по мере необходимости, но не реже одного раза в день.
2.2. Отделка стен, потолков и полов помещений должна допускать влажную уборку с использованием дезинфицирующих средств. В качестве отделочных материалов могут быть использованы водостойкие краски, эмали или кафельные глазурованные (майоликовые) плитки светлых тонов. Полы покрываются керамическими неглазурованными (терракотовыми) плитками или линолеумом с обязательной сваркой швов.
2.3. Поверхность аптечного оборудования как снаружи, так и внутри должна быть гладкой, выполненной из материалов, устойчивых к воздействию медикаментов, а в необходимых случаях и к химическим реактивам. Оборудование и аптечная мебель располагаются так, чтобы не оставлять недоступных для уборки мест и не загораживать источники света. Не допускается размещение в производственных помещениях оборудования, не имеющего отношение к выполняемым работам.
2.4 Помещения хранения лекарственных средства и изделий медицинского назначения должны быть обеспечены необходимым количеством стеллажей, шкафов, поддонов, подтоварников и т.п. Не допускается размещение лекарственных средств на полу без подтоварников.
Установка стеллажей осуществляется таким образом, чтобы они находились на расстоянии 0,6-0,7 м от наружных стен, не менее 0,5 м от потолка и не менее 0,25 м от пола. Стеллажи по отношению к окнам должны быть расположены так, чтобы проходы были освещены, а расстояние между стеллажами составляло не менее 0,75 м обеспечивало свободный доступ к товару.
Помещения аптечных складов и аптек должны содержаться в чистоте, периодически (не реже одного раза в день) убираться влажным способом с применением разрешенных моющих средств.
2.5. В летний период окна и витрины, расположенные на солнечной стороне, должны быть обеспечены солнцезащитными устройствами (жалюзи, маркизы, и т.п.), которые располагаются с внешней стороны окон или между рамами.
2.6. Оконные фрамуги или форточки, используемые для проветривания помещений, защищаются съемными металлическими или пластмассовыми сетками с размерами ячейки не более 2x3 мм.
2.7. В помещениях, предназначенных для хранения лекарственных средств и изделий медицинского назначения не допускается наличие занавеса, ковров на полу, разведение цветов, вывешивание стенгазет, плакатов. Для этого могут быть использованы коридоры, комнаты отдыха персонала аптек, кабинеты.
Информационные стенды и таблицы, необходимые для работы в помещениях, должны изготовляться из материалов, допускающих влажную уборку и дезинфекцию.
2.8. Рабочие места персонала аптеки в зоне обслуживания посетителей должны быть оснащены устройствами, предохраняющими работников от прямой капельной инфекции.
В месте установки раковины должна быть предусмотрена отделка стен глазурованной плиткой или другими влагостойкими материалами высотой 1,6 м от пола и шириной 20 см с каждой стороны.
2.9. Аптека (филиалы) должна быть оснащена специальной аптечной мебелью, производственным оборудованием, холодильниками для хранения термолабильных лекарственных средств, торговли лекарственными средствами и информации о них.
2.10. Помещение реализации (торговый зал) и помещение для распаковки должны быть оснащены кондиционером для обеспечения соответствующего температурного режима.
Помещения хранения готовых лекарственных средств должны быть оснащены вентиляцией и термометром для контроля температуры воздуха. Термометр закрепляется на внутренних стенах хранилища вдали от нагревательных приборов на высоте 1,5 — 1,7 м от пола и 1 м от дверей.
2.11. Аптека (филиалы) должна быть оснащена переносной кварцевой лампой для проведения профилактических дезинфекционных работ.
2.12. Складские помещения аптек могут быть расположены в цокольных помещениях. При этом высота складских помещений должна быть не менее 2,4 м.
2.13. Естественное проветривание помещений аптек и их филиалов осуществляются с помощью фрамуг и форточек, площадь которых должна быть не менее 1/50 площади пола в зимний и переходный периоды и с помощью оконных проемов — в летний период года.
III. Санитарное благоустройство и освещенность аптечных помещений
3.1. Рекомендуется центральное водяное отопление аптечных помещений. Аптеки (филиалы), расположенные в жилых или общественных зданиях, подключаются к отопительной системе здания.
3.2. Наиболее предпочтительным являются гладкостенные радиаторы, легко доступные для очистки от пыли.
3.3. При проектировании теплоснабжения, отопления, вентиляции, кондиционирования воздуха и горячего водоснабжения в зданиях аптек (филиалов) следует выполнять требования глав КМК 2.10.04-96 «Строительная теплотехника», КМК 2.04.05-97 «Отопление, вентиляция и кондиционирование воздуха» и настоящего раздела.
3.4. В аптеках, расположенных в отдельно стоящих зданиях, а также в сельской местности, возможно наличие автономного отопления. Не допускается обогревание помещений газовыми приборами с открытым пламенем или электронагревательными приборами с открытой спиралью.
3.5. Расчетная температура воздуха в торговом зале в отопительный период должна быть не менее 16°С.
3.6. В аптечных помещениях допускается естественная общеобменная вентиляция, обеспечивающая не менее чем однократный воздухообмен за 1 час.
3.7. В качестве теплоносителя систем водяного отопления следует принимать воду температурой не ниже 70° С.
3.8. Нагревательные приборы систем отопления следует размещать под окнами.
3.9. Оборудование вентиляционных систем следует размещать также в цокольных этажах.
3.10. Искусственное освещение помещений аптек (филиалов) следует проектировать в соответствии с КМК 2.01.05-98 «Естественное и искусственное освещение» и требованиями настоящего пункта
|
Помещения
|
Освещенность рабочих поверхностей, лк
|
Источник света
|
Плоскость, для которой нормируется освещенность
|
|
1. Торговый зал и помещения персонала
|
150
|
л.л.**
|
Г*-0.8
|
|
2. Рецептурный отдел, отделы готовых лекарственных средств***, ручной продажи, оптики
|
300
|
л.л.
|
Г-0.8
|
* Г — горизонтальная поверхность, В — вертикальная поверхность;
** л.л. — люминесцентная лампа;
*** В помещениях требуется штепсельная розетка для местного освещения.
3.11. Освещение помещений аптек и филиалов осуществляется лампами накаливания и люминесцентными лампами, при этом предусматриваемые для установки люминесцентные светильники должны быть укомплектованы пускорегулирующими аппаратами со сниженным уровнем шума.
3.12. Светильники общего освещения помещений, размещенные на потолках, должны быть со сплошными (закрытыми) рассеивателями.
3.13. Аптеки и их филиалы должны быть снабжены внешней и местной телефонной связью.
3.14. Для обеспечения достаточного уровня естественного освещения в помещениях аптек и филиалов в зале обслуживания и комнате приема пищи необходимо предусматривать коэффициенты минимальной естественной освещенности с КЭО 1,5 процентов.
3.15. Водоснабжение аптек и филиалов осуществляется путем присоединения к водопроводной сети или устройства собственного водопровода из местного водоисточника.
3.16. Внутренняя разводка должна обеспечивать подачу холодной и горячей воды в уборную и комнату приема пищи.
3.17. Для удаления сточных вод аптеки и филиалов должны быть подключены к системе канализации, при ее отсутствии применяются выгребные ямы с вывозной системой. Для сбора твердых отбросов устанавливаются мусоросборники с герметичными крышками.
ПРИЛОЖЕНИЕ № 3
к Положению о порядке лицензирования
розничной реализации лекарственных
средств и изделий медицинского назначения
|
(на официальном бланке организации)
|
|
УВЕДОМЛЕНИЕ
лицензирующего органа об изменении заведующего аптекой, заведующего филиалом аптеки, закрытии филиала аптеки
|
I. Общие сведения о лицензиате:
1.1. Полное наименование лицензиата:
1.2. Идентификационный номер налогоплательщика лицензиата:
1.3. Местонахождение (почтовый адрес) лицензиата:
1.4. Адрес, по которому осуществляется лицензионная деятельность:
1.5. Номер выданной лицензии:
II. Уведомление о, об:
2.1.Изменении:
□заведующего аптекой;
□заведующего филиалом аптеки;
□закрытии филиала аптеки:
2.2. Фамилия, имя, отчество (при наличии) вновь назначенного работника:
2.3. Паспортные данные (серия, номер, дата выдачи, наименование органа, выдавшего паспорт):
2.4. Сведения о дипломе, о высшем фармацевтическом образовании (дата выдачи, кем выдан) — для заведующего аптеки, сведения о дипломе о среднем специальном профессиональном образовании ассистента (помощника) фармацевта:
2.5. Наименование специальности:
2.6. Дата принятия в штат лицензиата вновь назначенного работника:
2.7. Дата и номер приказа о принятии на работу:
2.8. Адрес, по которому осуществление лицензионной деятельность прекращается в связи с закрытием филиала:
2.9. Дата закрытия филиала аптеки, по которому лицензионная деятельность прекращена:
2.10.Даты выдачи и номер лицензии:
2.11. Причина закрытия филиала:
III. Сведения о заменяемом работнике (заведующем).
3.1. Фамилия, имя, отчество (при наличии) уволенного заведующего аптеки, филиала аптеки:
3.2. Паспортные данные (серия, номер, дата выдачи, наименование органа, выдавшего паспорт):
3.3. Дата увольнения заведующего аптеки, заведующего филиалом аптеки:
|
|
__________________________________
|
| _____________________________________________ |
|
(руководитель лицензиата)
|
(подпись)
|
(фамилия, инициалы)
|
|
М.П.*
|
|
|
|
|
|
|
|
*) при наличии печати — для субъектов малого предпринимательства
ПРИЛОЖЕНИЕ № 4
к Положению о порядке лицензирования
розничной реализации лекарственных
средств и изделий медицинского назначения
|
ЗАЯВЛЕНИЕ
о выдаче лицензии на осуществление розничной реализации лекарственных средств и изделий медицинского назначения
|
I. Цель обращения:
1.1. □ выдача лицензии;
1.2. □ продление срока действия;
1.3. □ переоформление;
1.4. □ о прекращение действия лицензии.
II. Сведения о заявителе:
2.1. Полное наименование юридического лица:
2.2. Идентификационный номер налогоплательщика (ИНН):
III. Местонахождение (почтовый адрес) заявителя:
3.1. Улица:
3.1.1. Тупик номер:
3.1.2. Проезд номер:
3.1.3. Квартира номер:
3.2. Дом номер:
3.2.1. Квартира номер:
3.3. Город:
3.4. Поселок:
3.5. Кишлак (аул):
3.6. Район:
3.7. Область:
3.8. Республика:
3.9. Почтовый индекс:
IV. Контактные данные:
4.1. Номер мобильного телефона с кодом:
4.2. Номер телефона с кодом:
4.3. Адрес электронной почты:
V. Адрес (адреса) места осуществления лицензии на осуществление розничной реализации лекарственных средств и изделий медицинского назначения:
□ по адресу, указанному в разделе 3 настоящего заявления;
□ иному адресу:
5.1. Улица:
5.1.1. Тупик номер:
5.1.2. Проезд номер:
5.1.3. Квартира номер:
5.2. Дом номер:
5.2.1. Квартира номер:
5.3. Город:
5.4. Поселок:
5.5. Кишлак (аул):
5.6. Район:
5.7. Область:
5.8. Республика:
5.9. Почтовый индекс:
VI. Сведения о заведующем аптекой (заведующем филиалом аптеки):
6.1. Фамилия, имя, отчество (при наличии) вновь назначенного работника:
6.2. Паспортные данные (серия, номер, дата выдачи, наименование органа, выдавшего паспорт):
6.3. Сведения о дипломе о высшем фармацевтическом образовании (дата выдачи, кем выдан) — для заведующего аптеки, сведения о дипломе о среднем специальном профессиональном образовании ассистента (помощника) фармацевта:
6.4. Наименование специальности:
6.5. Дата принятия в штат лицензиата вновь назначенного работника:
6.6. Дата и номер приказа о принятии на работу:
6.7. Сведения о сертификате о повышении квалификации заведующего аптеки, заведующего филиала аптеки (номер, дата выдачи, кем выдан):
VII. Сведения о здании (помещении) для осуществления лицензионной деятельности, расположенного по адресу, указанному в разделе 5 настоящего заявления:
□ принадлежит на праве собственности или ином вещном праве;
□ арендованное;
7.1. В случае указания на принадлежность на праве собственности или ином вещном праве указать:
7.1.1. Кадастровый номер объекта (здания, помещения):
7.2. В случае аренды здания помещения указываются сведения о заключенном договоре аренды здания (помещения):
7.2.1. Номер договора аренды:
7.2.2. Дата подписания договора аренды:
7.2.3. Срок (период) аренды
7.2.4. Наименование арендатора:
VIII. Способ уведомления лицензиата о дате и времени, фамилии и инициалах уполномоченного представителя рабочего органа, выезжающего на местонахождения помещения соискателя лицензии для изучения его соответствия лицензионным требованиям и условиям:
8.1. По мобильному телефону (указывается номер с кодом):
8.2. По смс — сообщению (указывается номер с кодом):
8.3. По электронной почте (указывается адрес):
IX. Иные сведения, указываемые в случае:
9.1. Продлении срока действия лицензии:
9.1.1. Номер лицензии:
9.1.2. Дата оказания действия лицензии:
9.2. Переоформлении лицензии:
9.2.1. Номер лицензии:
9.2.2. Новая организационно-правовая форма:
9.2.3. Новое наименование лицензиата:
9.2.4. Новый адрес местонахождения (почтовый адрес) лицензиата:
9.2.5. Дата государственной регистрации изменений:
9.3.Прекращение действия лицензии:
9.3.1. Номер лицензии:
9.3.2. Причина прекращения действия лицензии:
X. Сведения о банковских реквизитах:
10.1. Наименование обслуживающего банка:
10.2. Код банка МФО:
10.3. Номер расчетного счета:
XI. Подтверждение соблюдения лицензионных требований и условий:
□ лицензионными требованиями и условиями ознакомлен и обязуюсь соблюдать;
□ подтверждаю, что здание (помещение) полностью соответствует требованиям к помещению, материально-технической базе для осуществления розничной реализации лекарственных средств и изделий медицинского назначения;
□ подтверждаю, что здание (помещение), указанное в разделе 5 настоящего заявления, не включено в реестр адресов аптек, действие лицензии которых было прекращено вследствие выявленных нарушений законодательства, в том числе за грубое нарушение порядка ценообразования лекарственных средств и изделий медицинского назначения;
□ подтверждаю, что работник (заведующий аптекой, заведующий филиалом), указанный в разделе 6 настоящего заявления, не включен в реестр работников аптек, действие лицензии которых было прекращено вследствие выявленных нарушений законодательства, в том числе за грубое нарушение порядка ценообразования лекарственных средств и изделий медицинского назначения;
□ подтверждаю, что сведения, содержащиеся в представляемых для получения лицензии на осуществление розничной реализации лекарственных средств и изделий медицинского назначения (заявлении и прилагаемых документах), достоверны.
□ мне известно, что в случае представления недостоверных сведений, мне может быть отказано в выдаче лицензии и я несу ответственность, установленную законодательством.
|
| _____________________________________________ |
|
__________________________________
|
|
(руководитель организации)
|
|
(подпись) фамилия, инициалы
|
|
М.П.*
|
|
|
|
|
|
|
|
* При наличии печати — для субъектов малого предпринимательства.
ПРИЛОЖЕНИЕ № 5
к Положению о порядке лицензирования
розничной реализации лекарственных
средств и изделий медицинского назначения
|
ЗАКЛЮЧЕНИЕ
об изучении соискателя лицензии на соответствие лицензионным требованиям и условиям
|
I. Общие сведения:
1.1. Дата проведения изучения:
1.2. Место проведения изучения:
II. Общие сведения об уполномоченном представителе рабочего органа:
2.1. Фамилия, инициалы лица, проведшего изучения:
2.2. Номер и дата выдачи служебного удостоверения:
2.3. Место работы:
2.4. Контактный телефон с кодом:
III. Сведения о разъяснении порядка проведения изучения:
□ соискателю лицензиата разъяснен порядок проведения изучения соответствия лицензионным требованиям и условиям.
Фамилия, инициалы лица (руководителя соискателя лицензии, заведующего аптеки, заведующего филиалом аптеки), которому разъяснён порядок проведения изучения соответствия соискателя лицензии лицензионным требованиям и условиям:
IV. Сведения о соискателе лицензии:
4.1. Полное наименование соискателя лицензии:
4.2. Местонахождение (почтовый адрес):
4.3. Адрес здания (помещения), где планируется осуществление лицензионной деятельности:
4.4. Лицензионная деятельность, указанная в заявлении:
4.5. Контактный телефон с кодом:
V. Сведения по итогам проведения изучения соискателя лицензии лицензионным требованиям и условиям:
5.1. Материально-техническая база аптеки (филиала аптеки):
5.1.1. Собственником здания (помещения) является:
5.1.2.Свидетельство о государственной регистрации права на здания, сооружения и многолетние насаждения Серия __ №________ от ________________
5.1.3. Помещение используется на основании договора аренды от ______ №_____ сроком с «____»________ по «___» ________ г.
5.1.4. Местонахождение здания и помещений:
5.1.5. Наличие соответствующего ремонта:
5.1.6. Санитарно-техническое состояние:
|
| 5.1.7. Водоснабжение: __________________________________________________________________________ |
|
(горячее, холодное) централизованное, автономное
|
|
| 5.1.8. Канализация _____________________________________________________________________________ |
| (централизованное, автономное)
|
|
| 5.1.9. Отопление _______________________________________________________________________________ |
| (централизованное, автономное)
|
|
| 5.1.10. Освещение: _____________________________________________________________________________ |
| (естественное, искусственное — лампы дневного света)
|
|
| 5.1.11. Вентиляция: ____________________________________________________________________________ |
| (естественное проветривание, приточно-вытяжная)
|
|
5.1.12. Телефон (городской номер с кодом):
5.2. Внешнее оформление аптеки (филиала аптеки):
5.2.1. Вывеска:
5.3. Общая площадь помещений составляет: _______ квадратных метров.
5.4. Информация о здании (помещении): |
|
№
|
Состав помещений
|
Площадь помещения (кв.м)
|
Отделка помещений
|
|
норматив
|
фактически
|
пол
|
стены
|
потолок
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
1.
|
Кабинет заведующего, бухгалтерия*
|
6
|
|
|
|
|
|
2.
|
Торговый зал, в том числе:
зона обслуживания посетителей,
зона рабочих мест
|
16
8
8
|
|
|
|
|
|
3.
|
Помещение для готовых лекарственных препаратов (с холодильным оборудованием для термолябильных препаратов) и изделий медицинского назначения
|
12
|
|
|
|
|
|
4.
|
Комплектовочно-экспедиционное помещение  * *
|
14
|
|
|
|
|
|
5.
|
Помещение для изделий медицинского назначения*
|
4
|
|
|
|
|
|
6.
|
Подсобное помещение для хранения личных вещей и спецодежды и приема пищи
|
4
|
|
|
|
|
|
7.
| Уборная с умывальником |
2
|
|
|
|
|
*) Действительно для аптек, имеющих филиалы.
| 5.5. Оснащение и оборудование: |
|
|
|
|
|
|
|
|
|
|
Наименование оборудования
|
Количество, шт.
|
стол канцелярский
стул
шкаф книжный
сейф для хранения документов
шкаф для хранения верхней и спецодежды
дезсредства и хозяйственный инвентарь для обеспечения сан. режима витрина и прилавок
стеллаж
поддон и подтоварник
холодильник, марка ______________
прибор для регистрации параметров воздуха — термометр, психрометр или гигрометр (наименование, марка): __________________________
кондиционер: наименование, марка_______________
кварцевая лампа для обработки помещений________
солнцезащитные устройства (жалюзи, маркизы) ________
другие технические средства (компьютер, ксерокс, телефон/факс):___ нормативная литература по фармацевтической деятельности _________________
утвержденный перечень социально значимых лекарственных средств и изделий медицинского назначения с фиксированными ценами на государственном и русском языках, размером шрифта не менее 12_________ |
|
| VI. Сведения о персонале аптеки, филиала аптеки: |
|
|
|
|
|
№
|
Фамилия, имя, отчество
|
Должность
|
Сведения о принятии на работу (Приказ №, дата в трудовой книжке)
|
Образование, специальность (диплом, кем и когда выдан, №, серия)
|
Стаж общий
|
Курсы повышения квалификации (сертификат №, дата выдачи, кем выдан)
|
|
1.
|
|
|
|
|
|
|
|
2.
|
|
|
|
|
|
|
| VII. Заключение: |
|
|
|
|
|
|
|
|
|
| 7.1. Содержание помещений, оснащенность, площадь и состав, их параметры, материально-техническая база, оборудование и персонал аптеки (филиала аптеки)____________________________________________________ |
|
|
|
|
|
|
(соответствует /не соответствует лицензионным требованиям и условиям)
|
7.2. Замечания:
7.3. Предложения: |
|
|
|
|
|
|
|
|
|
| Уполномоченный представитель |
(подпись)
|
__________________________________________
|
|
|
|
|
|
|
|
|
(фамилия, инициалы)
|
| VIII. Сведения о согласии соискателя лицензии с проведенным изучением: |
| □ Ознакомлен и согласен: _______________________________________________________________________ |
|
|
|
(фамилия, инициалы и подпись соискателя лицензии)
|
| □ Ознакомлен и не согласен: _____________________________________________________________________ |
|
(указываются причины несогласия) (фамилия, инициалы и подпись соискателя лицензии)
|
| □ Отказался подписать: _________________________________________________________________________ |
|
|
|
|
(фамилия, инициалы и подпись уполномоченного представителя рабочего органа)
|
ПРИЛОЖЕНИЕ № 6
к Положению о порядке лицензирования
розничной реализации лекарственных
средств и изделий медицинского назначения
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Серия _____ №_______
|
|
(Изображение Государственного Герба Республики Узбекистан)
______________________________________________________
(наименование лицензирующего органа)
ЛИЦЕНЗИЯ
№__________________
(номер лицензии)
|
|
Настоящая лицензия на право осуществления розничной реализации лекарственных средств и изделий
медицинского назначения выдана:
|
| ____________________________________________________________________________________________ |
|
(полное фирменное наименование юридического лица, с указанием организационно-правовой формы)
|
| Местонахождение (почтовый адрес): |
|
|
|
|
| _________________________________ |
| ____________________________________________________________________________________________ |
| Идентификационный номер налогоплательщика (ИНН): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Дата выдачи лицензии: |
|
|
|
|
|
|
|
|
|
|
| «____»_______________20___г. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(число, месяц, год)
|
| Срок действия лицензии до: |
|
|
|
|
|
|
|
|
|
«____»_______________20___г.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(число, месяц, год)
|
| Порядковый номер по реестру лицензии: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Местонахождение (адрес), по которому осуществляется лицензионная деятельность: |
____________________________________________________________________________________________
____________________________________________________________________________________________ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Уполномоченное лицо: |
_________________
|
|
_____________________________________________
|
|
|
|
|
|
|
|
|
(подпись)
|
|
(Ф.И.О. руководителя лицензирующего органа)
|
|
|
|
|
|
|
|
|
М.П.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ПРИЛОЖЕНИЕ № 2
к постановлению Кабинета Министров
от 12 мая 2017 года № 284
ПОЛОЖЕНИЕ
о территориальной комиссии по лицензированию розничной реализации лекарственных средств и изделий медицинского назначения
Глава 1. Общие положения
1. Территориальная комиссия по лицензированию розничной реализации лекарственных средств и изделий медицинского назначения (далее — территориальная комиссия) создается при Совете Министров Республики Каракалпакстан, хокимиятах областей и города Ташкента.
Территориальная комиссия принимает решения о выдаче (продлении срока действия), приостановлении или прекращении действия, аннулировании и переоформлении лицензий на розничную реализацию лекарственных средств и изделий медицинского назначения.
2. Территориальная комиссия осуществляет свою деятельность в соответствии с Конституцией Республики Узбекистан, законами Республики Узбекистан, постановлениями палат Олий Мажлиса Республики Узбекистан, указами, постановлениями и распоряжениями Президента Республики Узбекистан, постановлениями и распоряжениями Кабинета Министров Республики Узбекистан, настоящим Положением и другими актами законодательства.
3. Персональный состав территориальной комиссии формируется на основании типового состава, определенного Кабинетом Министров Республики Узбекистан, и утверждается решением Председателя Совета Министров Республики Каракалпакстан, хокимов областей и города Ташкента.
4. Координация и мониторинг за деятельностью территориальных комиссий осуществляется Кабинетом Министров Республики Узбекистан.
5. Министерство здравоохранения Республики Каракалпакстан, территориальные управления здравоохранения и Главное управление здравоохранения города Ташкента выполняют функции рабочего органа территориальной комиссии.
Глава 2. Основные функции территориальной комиссии
6. Основными функциями территориальной комиссии являются:
рассмотрение заявлений соискателей лицензий о выдаче (продлении сроков действия), приостановлении или прекращении действия, аннулировании и переоформлении лицензии на право осуществления розничной реализации лекарственных средств и изделий медицинского назначения;
принятие решений о выдаче (продлении сроков действия), приостановлении или прекращении действия, аннулировании и переоформлении лицензии на право осуществления розничной реализации лекарственных средств и изделий медицинского назначения;
принятие решения о выдаче дубликата взамен утраченной или пришедшей в негодность лицензии;
содействие рабочему органу при формировании экспертных групп для экспертизы документов по лицензированию розничной реализации лекарственных средств и изделий медицинского назначения;
контроль за соблюдением лицензиатом лицензионных требований и условий;
изучение экспертных заключений, подготовленных рабочим органом по документам соискателей лицензий и принятие по ним соответствующих решений;
организация проверки выполнения требований и условий лицензионного соглашения по розничной реализации лекарственных средств и изделий медицинского назначения;
содействие лицензирующему органу в реализации его полномочий, предусмотренных статьей 6 Закона Республики Узбекистан «О лицензировании отдельных видов деятельности;
содействие лицензирующему орган в привлечении на договорной основе экспертов для рассмотрения представленных соискателем лицензии документов;
содействие рабочему органу при определении уполномоченного представителя рабочего органа, осуществляющего выезд на местонахождения соискателя лицензии для проведения соответствующих изучений;
организация эффективного информационного взаимодействия с рабочим органом, включая содействие по получению рабочим органом необходимых для выдачи лицензии документов и информации, имеющихся в других уполномоченных органах, в установленном порядке посредством информационного взаимодействия, в том числе в электронном виде;
покрытие на договорной основе расходов рабочего органа, связанных с выездом на местонахождение соискателя лицензии для проведения соответствующего изучения;
рассмотрение вопросов, вынесенных Центром государственных услуг, связанных с оспариванием отказа соискателю лицензии в выдачи лицензии на осуществление розничной реализации лекарственных средств и изделий медицинского назначения;
(абзац четырнадцатый пункта 6 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
рассмотрение жалоб соискателя лицензии на действия (бездействия) рабочего органа;
осуществление контроля за соблюдением рабочим органом порядка и сроков рассмотрения документов о выдачи лицензии, переоформлении лицензии, подготовки заключения о соответствии либо несоответствии лицензиата лицензионным требованиям и условиям.
7. Дополнительно к функциям, предусмотренным пунктом 6 настоящего Положения члены территориальной комиссии выполняют:
председатель территориальной комиссии — проводит заседания, изучает выводы членов территориальной комиссии, особое мнение, своевременно подписывает решения территориальной комиссии;
секретарь территориальной комиссии — рассматривает представленные документы и обеспечивает своевременный выезд на местонахождение соискателя лицензии уполномоченного представителя для проведения изучения соответствия созданных условий, предназначенных для осуществления лицензируемого вида деятельности лицензионным требованиям и условиям;
главные Государственные санитарные врачи Республики Каракалпакстан, областей и города Ташкента — изучают и, при необходимости разъясняют членам комиссии заключения уполномоченного представителя рабочего органа;
министр юстиции Республики Каракалпакстан, начальники управлений юстиции областей и города Ташкента — изучают соблюдение порядка оказания государственной услуги, в том числе Центром государственных услуг;
(абзац пятый пункта 7 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
начальники Управлений по земельным ресурсам и государственному кадастру Республики Каракалпакстан, областей и города Ташкента — изучают сведения в части права собственности или иного вещного права на здание (помещение), договоров аренды для осуществления розничной реализации лекарственных средств и изделий медицинского назначения;
начальники Государственных налоговых управлений Республики Каракалпакстан, областей и города Ташкента — изучают наличие контрольно-кассовых машин, терминалов;
начальники территориальных органов Государственного комитета Республики Узбекистан по содействию приватизированным предприятиям и развитию конкуренции — изучают вопросы соблюдения законодательства о защите прав потребителей.
8. До проведения заседания члены территориальных комиссий должны ознакомится с материалами заседания и быть готовыми к обсуждению вопросов повестки дня.
9. Территориальная комиссия выполняет и иные функции в соответствии с законодательством.
Глава 3. Права и обязанности территориальной комиссии
10. Территориальная комиссия имеет право:
в пределах своей компетенции запрашивать необходимые материалы у территориальных подразделений органов государственного управления;
при необходимости, запрашивать у рабочего органа дополнительные документы для уточнения сведений о деятельности аптек;
привлекать на договорной основе экспертов из числа специалистов органов санитарно-эпидемиологического надзора для экспертизы документов, представленных соискателем лицензии в качестве уполномоченного представителя рабочего органа;
организовывать и контролировать деятельность рабочего органа.
11. Лицензирующий орган, территориальная комиссия, рабочий орган, а также их члены не вправе создавать либо участвовать в качестве учредителей (участников) в деятельности предприятий, организаций и учреждений, занимающихся розничной реализацией лекарственных средств и изделий медицинского назначения, за исключением случаев, предусмотренных законодательством.
12. Территориальная комиссия обязана:
уведомлять в порядке, установленном Положением о порядке лицензирования розничной реализации лекарственных средств и изделий медицинского назначения, соискателя лицензии о принятом решении после принятия лицензирующим органом соответствующего решения;
вносить на рассмотрение лицензирующего органа предложения по установлению срока устранения лицензиатом обстоятельств, повлекших за собой приостановление действия лицензии;
подготавливать и вносить лицензирующему органу решение о возобновлении действия лицензии в случае устранения лицензиатом обстоятельств, повлекших за собой приостановление действия лицензии, в трехдневный срок со дня получения подтверждения об устранении указанных обстоятельств.
Территориальная комиссия несет и иные обязательства в соответствии с законодательством.
Глава 4. Порядок работы территориальной комиссии
13. Заседания территориальной комиссии проводятся по мере внесения рабочим органом соответствующих заявлений с экспертными заключениями и проектом протокола, с указанием в нем решений о выдачи либо об отказе в выдаче лицензии, с учетом сроков, установленных для рассмотрения документов о выдаче лицензии, переоформлении лицензии.
14. Заседания территориальной комиссии проводятся по мере поступления документов, но не реже двух раз в месяц. При необходимости, могут проводиться внеочередные заседания.
15. Экспертное заключение и предложение о выдаче или об отказе в выдаче лицензии с соответствующим проектом решения территориальной комиссии, подготовленное рабочим органом, доводится до сведения членов территориальной комиссии для ознакомления не менее чем за 3 дня до ее заседания.
16. Заседание территориальной комиссии проводится при условии участия в заседании не менее 1/2 ее членов. Решение территориальной комиссии принимается простым большинством голосов.
17. При несогласии одного из членов территориальной комиссии с решением комиссии он вправе письменно изложить свое мнение, которое прилагается к протоколу.
18. Решения территориальной комиссии оформляются протоколом.
19. При отсутствии председателя территориальной комиссии его функции выполняет заместитель председателя.
20. Территориальная комиссия ежемесячно до 10 числа месяца, следующего за отчетным, представляет отчет о своей деятельности по установленной форме в Кабинет Министров Республики Узбекистан.
Глава 5. Заключительные положения
21.Члены территориальной комиссии обязаны участвовать на заседаниях территориальной комиссии.
22. Лица, виновные в нарушении настоящего Положения, несут ответственность в установленном законодательством порядке.
ПРИЛОЖЕНИЕ № 3
к постановлению Кабинета Министров
от 12 мая 2017 года № 284
ТИПОВОЙ СОСТАВ
территориальной комиссии по лицензированию розничной реализации лекарственных средств и изделий
медицинского назначения
|
по должности
|
—
|
председатель Совета Министров Республики Каракалпакстан, хокимы областей и города Ташкента, председатель территориальной Комиссии
|
|
по должности
|
—
|
заместитель Председателя Совета Министров Республики Каракалпакстан, заместители хокимов областей и
города Ташкента по вопросам экономики и развития предпринимательства, заместители председателя территориальной комиссии
|
|
по должности
|
—
|
министр здравоохранения Республики Каракалпакстан, начальники областных управлений здравоохранения, начальник Главного управления здравоохранения города Ташкента, секретарь территориальной комиссии
|
|
по должности
|
—
|
главные Государственные санитарные врачи Республики Каракалпакстан, областей и города Ташкента
|
|
по должности
|
—
|
министр юстиции Республики Каракалпакстан, начальники управлений юстиции областей и города Ташкента
|
|
по должности
|
—
|
начальники управлений по земельным ресурсам, геодезии, картографии и государственному кадастру Республики Каракалпакстан, областей и города Ташкента
|
|
по должности
|
—
|
начальники Государственных налоговых управлений Республики Каракалпакстан, областей и города Ташкента
|
|
по должности
|
—
|
начальники территориальных органов Государственного комитета Республики Узбекистан по содействию приватизированным предприятиям и развитию конкуренции
|
Примечание. при переходе членов территориальной комиссии на другую работу в ее состав включаются лица, вновь назначенные на эти должности либо на которых возложено выполнение соответствующих функций.
ПРИЛОЖЕНИЕ № 4
к постановлению Кабинета Министров
от 12 мая 2017 года № 284
ПОЛОЖЕНИЕ
о порядке лицензирования фармацевтическойдеятельности, кроме розничной реализации лекарственных средств
и изделий медицинского назначения
Глава 1. Общие положения
1. Настоящее Положение определяет порядок лицензирования следующих направлений (их части) фармацевтической деятельности (далее — фармацевтическая деятельность):
а) производство лекарственных средств и изделий медицинского назначения;
б) изготовление лекарственных средств и изделий медицинского назначения;
в) научно-исследовательская работа по созданию лекарственных средств и изделий медицинского назначения;
г) контроль качества лекарственных средств и изделий медицинского назначения;
д) оптовая реализация лекарственных средств и изделий медицинского назначения;
е) фасовка и оптовая реализация лекарственного сырья растительного происхождения.
Лицензирование фармацевтической деятельности осуществляется по схеме, согласно приложению к настоящему Положению.
2. Лицензирование фармацевтической деятельности осуществляется Министерством здравоохранения Республики Узбекистан (далее — лицензирующий орган) через Центры государственных услуг (далее — центры) либо через Единый портал интерактивных государственных услуг Республики Узбекистан (далее — Единый портал).
(абзац первый пункта 2 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
Для рассмотрения заявлений о выдаче лицензий, продлении их срока, подготовки заключений по ним в лицензирующем органе создается экспертная комиссия. Состав и положение об экспертной комиссии утверждаются лицензирующим органом. При этом в состав экспертной комиссии в обязательном порядке включаются специалисты соответствующего профиля и специалисты органов государственного санитарно-эпидемиологического надзора.
3. Лицензии на право осуществления направлений фармацевтической деятельности — производство лекарственных средств и изделий медицинского назначения, изготовление лекарственных средств и изделий медицинского назначения, научно-исследовательская работа по созданию лекарственных средств и изделий медицинского назначения, контроль качества лекарственных средств и изделий медицинского назначения и оптовая реализация лекарственных средств и изделий медицинского назначения выдаются только юридическим лицам, при этом лицензии на изготовление лекарственных средств и изделий медицинского назначения выдаются только аптекам.
Лицензии на право осуществления направления фармацевтической деятельности — фасовка и оптовая реализация лекарственного сырья растительного происхождения выдаются юридическим и физическим лицам.
Получение лицензии на направление фармацевтической деятельности, указанное в подпункте «а» пункта 1 настоящего Положения, дает лицензиатам право на осуществление оптовой реализации произведенных ими лекарственных средств и изделий медицинского назначения. Получение лицензии на направление фармацевтической деятельности, указанное в подпункте «б» пункта 1 настоящего Положения, дает право лицензиатам на осуществление розничной реализации изготовленных ими лекарственных средств и изделий медицинского назначения.
4. На осуществление фармацевтической деятельности выдаются типовые (простые) лицензии в установленном порядке.
5. Лицензия выдается сроком на пять лет. Лицензия может быть выдана на срок менее пяти лет только по заявлению соискателя лицензии.
6. Фармацевтическая деятельность может осуществляться юридическим или физическим лицом только по определенному в лицензии направлению (его части) деятельности.
При выдаче лицензии на право осуществления нескольких направлений (их частей) фармацевтической деятельности в лицензии указывается каждое из этих направлений (их части).
Глава 2. Лицензионные требования и условия
7. Лицензионными требованиями и условиями осуществления фармацевтической деятельности являются:
а) обязательное соблюдение законодательства о лекарственных средствах и фармацевтической деятельности, в том числе установленный порядок государственного регулирования цен на лекарственные средства и изделия медицинского назначения, а также нормативных документов в области технического регулирования в сфере производства, изготовления, хранения и оптовой реализации лекарственных средств и изделий медицинского назначения;
б) обязательное соблюдение экологических и санитарных правил, норм и гигиенических нормативов;
в) осуществление деятельности в пределах указанной в лицензии, а также по адресу (адресам) в соответствии с лицензионным соглашением;
г) в случае занятия оптовой реализацией лекарственных средств и изделий медицинского назначения, наличие в штате заведующего складом организации оптовой реализации лекарственных средств и изделий медицинского назначения с фармацевтическим образованием, а также имеющего сертификат о повышении квалификации и опыт работы, соответствующий должностным обязанностям;
д) в случае осуществления деятельности по производству лекарственных средств и изделий медицинского назначения, наличие в штате не менее двух ответственных специалистов по производству и контролю качества лекарственных средств и изделий медицинского назначения, имеющих специальное образование, сертификат о повышении квалификации и опыт работы, соответствующие должностным обязанностям;
е) в случае занятия изготовлением лекарственных средств и изделий медицинского назначения, наличие в штате юридического лица не менее одного работника — заведующего аптекой, имеющего высшее фармацевтическое образование, а также сертификат о повышении квалификации и опыт работы, соответствующий должностным обязанностям;
ж) наличие предназначенных для осуществления лицензируемого вида деятельности помещений, принадлежащих на праве собственности или ином вещном праве и соответствующие санитарным правилам, нормам и гигиеническим нормативам, а также нормативным документам в области технического регулирования;
з) создание условий для осуществления конкретного лицензируемого вида деятельности, включая использование соответствующей материально-технической базы, оборудования, иных технических средств;
и) для осуществления изготовления лекарственных средств и изделий медицинского назначения, а также фасовки и оптовой реализации лекарственного сырья растительного происхождения — обязательное заключение договора на проведение анализов лекарственных средств с уполномоченной контрольно-аналитической лабораторией;
к) уплата сборов, государственных пошлин в случаях, сроках и размерах, установленных настоящим Положением.
8. Требования к материально-технической базе, в том числе к оборудованию и иным техническим средствам, необходимым для осуществления соответствующего направления (его части) фармацевтической деятельности, а также к персоналу, определяются Министерством здравоохранения Республики Узбекистан в установленном порядке и подлежат обязательному опубликованию в Интернете.
Глава 3. Документы, необходимые для получения лицензии
9. Для получения лицензии соискатель лицензии представляет в центры либо через Единый портал в электронной форме:
(абзац первый пункта 9 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
а) заявление о выдаче лицензии, согласно утвержденной лицензирующим органом форме, с указанием:
наименования и организационно-правовой формы юридического лица, местонахождения (почтового адреса), наименования банка и номер расчетного счета банка — для юридических лиц;
фамилии, имени, отчества, данных документа, удостоверяющего личность гражданина — для физических лиц;
лицензируемого направления деятельности (его части), которую юридическое или физическое лицо намерено реализовать, и срока, в течение которого будет осуществляться указанное направление деятельности (его часть);
форма принятия уведомления о принятом решении лицензирующего органа;
электронный адрес соискателя лицензии и другие реквизиты;
б) сведения о наличии материально-технической базы, оборудования, иных технических средств и персонала в соответствии с требованиями пункта 8 настоящего Положения, согласно утвержденной лицензирующим органом форме.
10. Требование от соискателя лицензии представления сведений, не предусмотренных настоящим Положением, не допускается.
11. Лицензирующий орган самостоятельно получает необходимые для выдачи лицензии сведения, имеющиеся в других уполномоченных органах, согласно схеме электронного информационного взаимодействия при лицензировании фармацевтической деятельности, в установленном порядке посредством применения информационно-коммуникационных технологий, в том числе в электронном виде, за исключением документов и информации, предусмотренных пунктом 9настоящего Положения.
12. Соискатель лицензии подает заявление о выдаче лицензии с указанием сведений, предусмотренных пунктом 9настоящего Положения, в центр в явочном порядке либо через Единый портал. При подаче заявления о выдаче лицензии с приложением сведений, предусмотренных пунктом 9 настоящего Положения, в электронной форме через Единый портал, заявление подтверждается электронной цифровой подписью соискателя лицензии. Соискатель лицензии указывает в заявлении форму получения уведомления о принятом решении по результатам рассмотрения поданного им заявления.
(абзац первый пункта 12 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
Заявления, поданные через Единый портал, направляются непосредственно в лицензирующий орган, оказывающий государственную услугу.
Заявление с указанием необходимых сведений, представленное соискателем лицензии через Единый портал в электронной форме для получения лицензии, принимается ответственным секретарем экспертной комиссии с уведомлением об их получении, а также регистрируется автоматически Единым порталом с присвоением уникального регистрационного номера.
При подаче соискателем лицензии заявления с указанием необходимых сведений через центр, работник центра направляет данное заявление в лицензирующий орган в порядке, установленном законодательством.
(абзац четвертый пункта 12 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
13. За предоставление недостоверных или искаженных сведений соискатель лицензии несет ответственность в соответствии с законодательством.
Глава 4. Рассмотрение заявления и принятие решения о выдаче лицензии или об отказе в выдаче лицензии
14. За рассмотрение заявления с соискателя лицензии взимается сбор в двукратном размере минимальной заработной платы, установленной законодательством на день подачи заявления. В случае представления заявления о выдаче лицензии одновременно с открытием филиала, установленный сбор за рассмотрение заявления взимается за каждый открываемый филиал.
В случае подачи заявления о выдачи лицензии через Единый портал, средства в размере 20 процентов от суммы сбора за рассмотрение заявления зачисляются на лицевой счет внебюджетного фонда Агентства государственных услуг при Министерстве юстиции Республики Узбекистан, а оставшаяся часть средств зачисляется на счет лицензирующего органа.
(абзац второй пункта 14 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609
В случае обращения в явочном порядке в центры, средства в размере 20 процентов от суммы уплачиваемых сборов за рассмотрение заявлений зачисляются на лицевой счет внебюджетного фонда Агентства государственных услуг при Министерстве юстиции Республики Узбекистан в установленном порядке.
(абзац третий пункта 14 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
В случае отказа соискателя лицензии от поданного заявления сумма уплаченного сбора возврату не подлежит.
15. Решение о выдаче или об отказе в выдаче лицензии принимается в срок, не превышающий пятнадцати дней со дня получения заявления соискателя лицензии, с указанием необходимых сведений, независимо от способа его подачи.
16. Заявление соискателя лицензии со всеми необходимыми сведениями в день их приема вносится на рассмотрение экспертной комиссии. При этом сведения, представленные в электронной форме, могут вносится на рассмотрение экспертной комиссии посредством применения информационно-коммуникационных технологий.
17. Для определения соответствия созданных условий для осуществления лицензируемого направления (его части) деятельности установленным лицензионным требованиям и условиям экспертом экспертной комиссии проводится экспертиза с выездом на место.
Экспертиза соответствия условий для осуществления лицензируемого направления деятельности (его части) осуществляется за счет собственных средств лицензирующего органа.
По итогам экспертизы экспертом составляется заключение о соответствии или несоответствии соискателя лицензии установленным лицензионным требованиям и условиям согласно форме, утвержденой лицензирующим органом.
При осуществлении экспертизы соответствия созданных условий для осуществления лицензируемого направления (его части) деятельности с выездом на место, эксперт вправе делать копии необходимых документов для обоснования экспертного заключения.
По представленным сведениям и итогам экспертизы экспертной комиссией составляется протокольное решение о выдаче либо об отказе в выдаче лицензии.
Для подготовки соответствующих заключений лицензирующий орган вправе привлекать на договорной основе дополнительных экспертов.
Протокольное решение экспертной комиссии утверждается лицензирующим органом и является основанием для выдачи или отказа в выдаче лицензии.
Лицензирующий орган уведомляет соискателя лицензии о принятом решении в форме, указанной им в заявлении, с указанием реквизитов банковского счета и срока оплаты государственной пошлины
18. Лицензия выдается после получения информации об уплате государственной пошлины и после подписания им лицензионного соглашения в форме, указанной им в заявлении.
Лицензионное соглашение является документом, определяющим взаимные права и обязанности лицензирующего органа и лицензиата, и должно содержать:
фамилию, имя, отчество, должность лиц, подписавших соглашение;
наименование направления фармацевтической деятельности (его части), на осуществление которой выдается лицензия;
фамилию, имя, отчество заведующего склада организации оптовой реализации лекарственных средств и изделий медицинского назначения — для организаций, осуществляющих оптовую реализацию лекарственных средств и изделий медицинского назначения, фамилию, имя, отчество заведующего аптеки — для организаций, осуществляющих изготовление лекарственных средств и изделий медицинского назначения;
лицензионные требования и условия, предъявляемые к лицензиату;
срок действия лицензии, с указанием даты прекращения ее действия;
адрес (адреса), по которому(ым) будет осуществляться лицензируемое направление деятельности (его части);
ответственность сторон за нарушение требований и условий лицензионного соглашения;
порядок контроля со стороны лицензирующего органа за выполнением требований и условий лицензионного соглашения;
перечень нарушений лицензионных требований и условий, в том числе нарушений в сфере ценообразования лекарственных средств и изделий медицинского назначения, за которые может последовать приостановление или прекращение действия лицензии;
реквизиты сторон.
В случае переоформления лицензии в лицензионное соглашение одновременно вносятся изменения или дополнения либо составляется новое лицензионное соглашение.
В случае открытия (закрытия) филиала, изменения адреса осуществления направления (его части) деятельности, изменения заведующего складом организации оптовой реализации лекарственных средств и изделий медицинского назначения либо изменения заведующего аптеки, занимающейся изготовлением лекарственных средств и изделий медицинского назначения в лицензионное соглашение вносятся изменения или дополнения либо составляется новое лицензионное соглашение в порядке, предусмотренном главой 6 настоящего Положения.
Лицензионное соглашение составляется в двух экземплярах — по одному экземпляру для лицензиата и лицензирующего органа.
Лицензии оформляются в установленном законодательством порядке.
Бланки лицензий являются документами строгой отчетности, имеют учетную серию, номер и степень защищенности. Форма бланков утверждается лицензирующим органом и изготавливается по его заказу типографским способом в ГПО «Давлат белгиси». Руководитель лицензирующего органа несет ответственность за учет, сохранность и целевое использование бланков лицензий, а также за достоверное и своевременное внесение информации о выданных, приостановленных, возобновленных, переоформленных, аннулированных, а также прекращенных действием лицензиях в соответствующие информационные ресурсы.
Также, информация о выданных, приостановленных, возобновленных, переоформленных, аннулированных, а также прекращенных действием лицензий вносится в электронный реестр Комплекса информационных систем «Лицензия».
19. В случае, если лицензиат в течение трех месяцев с момента направления уведомления о принятии решения о выдаче лицензии не произвел уплату государственной пошлины за выдачу лицензии, либо не подписал лицензионное соглашение, лицензирующий орган вправе принять решение об аннулировании лицензии.
20. В выдаче лицензии может быть отказано по основаниям, установленным статьей 17 Закона Республики Узбекистан «О лицензировании отдельных видов деятельности».
Соискатель лицензии имеет право обжаловать решение лицензирующего органа об отказе в выдаче лицензии, а также действия (бездействие) должностного лица лицензирующего органа в порядке, установленном законодательством.
21. В случае принятия решения об отказе в выдаче лицензии, уведомление об отказе в выдаче лицензии направляется соискателю лицензии в форме, указанной им в заявлении, с указанием причин отказа и срока, в течение которого соискатель лицензии, устранив указанные причины, может представить заявление для повторного рассмотрения. Срок, указанный в уведомлении об отказе в выдаче лицензии, должен быть соразмерным времени, необходимом для устранения недостатков.
В случае устранения соискателем лицензии причин, послуживших основанием для отказа в выдаче лицензии, повторное рассмотрение заявления о выдаче лицензии осуществляется лицензирующим органом в срок, не превышающий пятнадцати дней со дня получения заявления соискателя лицензии со всеми необходимыми документами.
При этом повторно представленное заявление вносится на рассмотрение экспертной комиссии в день их приема.
По представленным документам и итогам повторной экспертизы составляется протокольное решение экспертной комиссии о выдаче либо об отказе в выдаче лицензии.
За повторное рассмотрение заявлений соискателей лицензий сбор не взимается.
При повторном рассмотрении заявления соискателя лицензии не допускается отказ в выдаче лицензии по новым основаниям, ранее не указанным в уведомлении об отказе в выдаче лицензии.
Заявление, поданное по истечению срока, указанного в уведомлении об отказе в выдаче лицензии, считается вновь поданным.
Глава 5. Переоформление лицензии, продление срока ее действия, выдача дубликата
22. В случае преобразования лицензиата, изменения его наименования или местонахождения (почтового адреса) лицензиат или его правопреемник обязан в месячный срок после прохождения перерегистрации представить в лицензирующий орган через центры либо Единый портал в электронной форме заявление о переоформлении лицензии, с приложением к нему соответствующих сведений и подлинника действующей лицензии.
(абзац первый пункта 22 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
В случае слияния лицензиатов — юридических лиц, имеющих на дату государственной регистрации вновь возникшего юридического лица лицензии на осуществление одного и того же лицензируемого вида деятельности, допускается переоформление лицензии в порядке установленной главой 5 настоящего Положения.
Лицензирующий орган получает подтверждающие указанные сведения посредством автоматизированной системы государственной регистрации и постановки на учет субъектов предпринимательства в соответствии с законодательством.
В случае прекращения действия лицензии на часть (части) лицензируемого вида деятельности, лицензия подлежит переоформлению.
В случае изменения фамилии, имени, отчества или места жительства лицензиата — физического лица, лицензиат обязан в месячный срок после прохождения перерегистрации представить в лицензирующий орган через центры либо Единый портал в электронной форме заявление о переоформлении лицензии, с приложением к нему соответствующих сведений и подлинника действующей лицензии.
(абзац пятый пункта 22 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
23. До переоформления лицензии лицензиат осуществляет деятельность на основании ранее выданной лицензии.
При переоформлении лицензии лицензирующий орган вносит соответствующие изменения в реестр лицензий Комплекса информационных систем «Лицензия», формируемый в электронной форме.
Переоформление лицензии осуществляется в течение пяти дней со дня направления уведомления лицензиату о получении лицензирующим органом заявления о переоформлении лицензии или принятия решения о прекращении действия лицензии на часть (части) лицензируемого вида деятельности.
При переоформлении лицензии взимается сбор в половинном размере суммы, уплачиваемой за рассмотрение заявления соискателя лицензии о выдаче лицензии. В случае подачи заявления о переоформлении лицензии через Единый портал в электронной форме, средства в размере 20 процентов от суммы сбора зачисляются на лицевой счет внебюджетного фонда Агентства государственных услуг при Министерстве юстиции Республики Узбекистан, а оставшаяся часть средств зачисляется на счет лицензирующего органа.
(абзац четвертый пункта 23 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
В случае обращения в явочном порядке в центры, средства в размере 20 процентов от суммы уплачиваемых сборов за рассмотрение заявлений зачисляются на лицевой счет внебюджетного фонда Агентства государственных услуг при Министерстве юстиции Республики Узбекистан в установленном порядке.
(абзац пятый пункта 23 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
24. Лицензирующий орган, рассмотрев представленные документы, оформляет лицензию на новом бланке в установленном законодательстве порядке. Одновременно оформляются соответствующие изменения в лицензионном соглашении.
25. Срок действия лицензии может быть продлен по заявлению лицензиата. Продление срока действия лицензии осуществляется в порядке, предусмотренном для получения лицензии.
Заявление о продлении срока действия лицензии должно быть подано в лицензирующий орган не позднее двух месяцев до истечения срока действия лицензии.
26. В случае утраты лицензии, лицензионного соглашения или их порчи выдается дубликат. Для получения дубликата лицензиат обращается в центры либо Единый портал с заявлением и документом, подтверждающим утрату лицензии и/или лицензионного соглашения, а также уплатив половину суммы сбора, предусмотренного для выдачи лицензии. В случае подачи заявления через Единый портал в электронной форме, средства в размере 20 процентов от суммы сбора зачисляются на лицевой счет внебюджетного фонда Агентства государственных услуг при Министерстве юстиции Республики Узбекистан, а оставшаяся часть средств зачисляется на счет лицензирующего органа.
В случае обращения в явочном порядке в центры средства в размере 20 процентов от суммы уплачиваемых сборов за рассмотрение заявлений зачисляются на лицевой счет внебюджетного фонда Агентства государственных услуг при Министерстве юстиции Республики Узбекистан в установленном порядке.
(пункт 26 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
Глава 6. Порядок внесения изменений и дополнений в лицензионное соглашение или составление нового лицензионного соглашения
27. В случае открытия (закрытия) филиала лицензиата, изменения места осуществления деятельности, заведующего склада организации оптовой реализации лекарственных средств и изделий медицинского назначения либо заведующего аптеки по изготовлению лекарственных средств и изделий медицинского назначения, лицензиат обращается в центры в явочном порядке либо через Единый портал в лицензирующий орган с заявлением о внесении в лицензионное соглашение изменений и дополнений либо составлении нового лицензионного соглашения.
(пункт 27 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
28. К заявлению о внесении в лицензионное соглашение изменений и дополнений либо составлении нового лицензионного соглашения прилагаются следующие сведения:
для открытия филиала, изменения места осуществления деятельности — сведения, указанные в подпункте «б» пункта 9 настоящего Положения, и лицензионное соглашение;
в случае замены заведующего оптового склада реализации лекарственных средств и изделий медицинского назначения — сведения о соответствии нового персонала требованиям, устанавливаемым Министерством здравоохранения Республики Узбекистан и лицензионное соглашение;
документ подтверждающий уплату сбора за рассмотрение заявления о переоформлении лицензионного соглашения.
29. Рассмотрение заявления о внесении в лицензионное соглашение изменений и дополнений либо составлении нового лицензионного соглашения, за исключением заявлений о закрытии филиалов или сокращении осуществляемых направлений (его части) деятельности, осуществляется в порядке, предусмотренном пунктами 16 и 17 настоящего Положения.
За рассмотрение заявления о внесении изменений и дополнений в лицензионное соглашение либо составлении нового лицензионного соглашения взимается сбор в размере двух минимальных заработных плат. В случае подачи заявления о переоформлении лицензии через Единый портал в электронной форме, средства в размере 20 процентов от суммы сбора зачисляются на лицевой счет внебюджетного фонда Агентства государственных услуг при Министерстве юстиции Республики Узбекистан, а оставшаяся часть средств зачисляется на счет лицензирующего органа.
(абзац первый пункта 30 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
В случае обращения в явочном порядке в центры, средства в размере 20 процентов от суммы уплачиваемых сборов за рассмотрение заявлений зачисляются на лицевой счет внебюджетного фонда Агентства государственных услуг при Министерстве юстиции Республики Узбекистан в установленном порядке.
(абзац второй пункта 30 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
В случае отказа лицензиата от поданного заявления сумма уплаченного сбора возврату не подлежит.
За внесение изменений и дополнений в лицензионное соглашение либо составление нового лицензионного соглашения государственная пошлина не взимается.
31. Основаниями для отказа во внесении изменений и дополнений в лицензионное соглашение либо составлении нового лицензионного соглашения являются:
представление лицензиатом ненадлежащим образом оформленных документов;
наличие в документах, представленных лицензиатом, недостоверных или искаженных сведений;
несоответствие лицензиата лицензионным требованиям и условиям.
32. При выявлении в процессе экспертизы фактов нарушения лицензиатом лицензионных требований и условий, принимается решение об отказе во внесении изменений и дополнений либо составлении нового лицензионного соглашения и выносится предписание об устранении нарушений, с указанием конкретного срока.
В случае не выполнения лицензиатом предписания, послужившего причиной отказа во внесении изменений и дополнений либо составлении нового лицензионного соглашения, лицензирующий орган вправе приостановить действие лицензии в установленном порядке.
33. Отказ во внесении изменений и дополнений в лицензионное соглашение либо составлении нового лицензионного соглашения, а также повторное рассмотрение заявления лицензиата производится в порядке, предусмотренном пунктом 21 настоящего Положения.
34. При внесении изменений и дополнений в лицензионное соглашение либо составлении нового лицензионного соглашения, лицензирующий орган вносит соответствующие изменения в реестр лицензий Комплекса информационных систем «Лицензия».
Глава 7. Контроль за соблюдением требований лицензионного соглашения
35. Контроль за соблюдением требований лицензионного соглашения осуществляется лицензирующим органом в порядке, установленном законодательством.
36. Лицензирующий орган в пределах своей компетенции имеет право:
проводить в установленном порядке плановые проверки соблюдения лицензиатом лицензионных требований и условий;
проводить в порядке, установленном законодательством, краткосрочные проверки соблюдения лицензиатом лицензионных требований и условий по решению специально уполномоченного органа — Республиканского совета по координации деятельности контролирующих органов Республики Узбекистан на основании обращений физических и юридических лиц о фактах нарушений законодательства;
запрашивать и получать от лицензиата необходимую информацию в установленном порядке;
составлять на основании результатов проверок акты (справки), с указанием конкретных нарушений лицензиатом лицензионных требований и условий;
выносить решения, обязывающие лицензиата устранить выявленные нарушения, и устанавливать сроки, в течение которых лицензиат обязан устранить выявленные нарушения;
в порядке, установленном законодательством, выносить решения или обращаться в суд о приостановлении, прекращении либо аннулировании лицензий;
в установленном порядке направлять в налоговые органы материалы о выявленных фактах осуществления хозяйствующими субъектами фармацевтической деятельности без лицензии для принятия предусмотренных законодательством мер.
37. При проверке соблюдения лицензионных требований и условий проверяющими работниками лицензирующего органа составляется акт в двух экземплярах, один из которых передается лицензиату, второй — остается у лицензирующего органа.
Глава 8. Приостановление, прекращение действия и аннулирование лицензии
38. Приостановление и прекращение действия лицензии, ее аннулирование производится в случаях и порядке, предусмотренных статьями 22, 23 и 24 Закона Республики Узбекистан «О лицензировании отдельных видов деятельности».
Сведения о приостановленных, аннулированных, а также прекращенных действием лицензиях вводятся лицензирующим органом в соответствующие информационные ресурсы.
39. Грубыми нарушениями лицензионных требований и условий, приводящими к прекращению в установленном порядке действия лицензии, являются:
систематические (два и более раза в течение одного года) нарушения лицензионных требований и условий, в том числе порядка ценообразования лекарственных средств и изделий медицинского назначения;
хранение и (или) реализация лекарственных средств и изделий медицинского назначения без сертификата соответствия;
производство и (или) реализация незарегистрированных, недоброкачественных, фальсифицированных лекарственных средств и изделий медицинского назначения, незаконных копий зарегистрированных в Республике Узбекистан лекарственных средств и изделий медицинского назначения;
хранение и (или) реализация организациями оптовой реализации лекарственных средств и изделий медицинского назначения незарегистрированных, недоброкачественных, фальсифицированных лекарственных средств и изделий медицинского назначения, а также незаконных копий зарегистрированных в Республике Узбекистан лекарственных средств и изделий медицинского назначения;
заведование складом оптовой реализации лекарственных средств и изделий медицинского назначения не имеющим фармацевтического образования;
осуществление лицензионной деятельности по адресу, не указанному в лицензионном соглашении.
40. Решение лицензирующего органа о приостановлении, прекращении действия или аннулирования лицензии может быть обжаловано в суде. В случае признания судом необоснованности прекращения действия лицензии, лицензирующий орган несет перед лицензиатом ответственность в размере понесенного им ущерба.
Глава 9. Реестр лицензий
41. Лицензирующий орган ведет реестр лицензий в Комплексе информационных систем «Лицензия».
42. В реестре лицензий должны быть указаны:
а) основные сведения о лицензиатах, включающие:
для юридических лиц — название организации и идентификационный номер налогоплательщика, организационная правовая форма, фамилия, имя, отчество руководителя организации;
для физических лиц — фамилия, имя, отчество лицензиата, паспортные данные, домашний адрес, телефон;
б) адрес, по которому будет осуществляться лицензируемое направление (его части) фармацевтической деятельности, рабочий телефон, факс;
в) даты выдачи и номер лицензий;
г) сроки действия лицензий;
д) лицензируемое направление (его части) фармацевтической деятельности;
е) основания и даты переоформления, продления срока действия, приостановления и возобновления действия лицензий;
ж) основания и даты прекращения действия лицензий;
з) основания и даты аннулирования лицензий.
Информация, содержащаяся в реестрах лицензий, размещается на веб-сайте лицензирующего органа в Комплексе информационных систем «Лицензия» и является открытой для ознакомления.
Глава 10. Государственная пошлина за выдачу лицензии
43. За выдачу или продление срока действия лицензии на фармацевтическую деятельность уплачивается государственная пошлина в десятикратном размере минимальной заработной платы.
44. Суммы уплачиваемых государственных пошлин распределяются в следующем порядке:
20 процентов зачисляются на лицевой счет внебюджетного фонда Агентства государственных услуг при Министерстве юстиции Республики Узбекистан — независимо от формы обращения (в электронном виде или в явочном порядке);
10 процентов зачисляются на счет лицензирующего органа — при электронной форме обращения;
оставшиеся средства направляются в республиканский бюджет.
(пункт 44 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
Глава 11. Заключительное положение
45. Лица виновные в нарушении требований настоящего Положения несут ответственность в соответствии с законодательством.
ПРИЛОЖЕНИЕ
к положению о порядке лицензирования
фармацевтической деятельности, кроме
розничной реализации лекарственных
средств и изделий медицинского назначения
СХЕМА
лицензирования фармацевтической деятельности, кроме розничной реализации лекарственных средств и изделий медицинского назначения
(приложение в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
ПРИЛОЖЕНИЕ № 5
к постановлению Кабинета Министров
от 12 мая 2017 года № 284
СХЕМА
электронного информационного взаимодействия при лицензировании фармацевтической деятельности
|
№
|
Наименование сведений, представляемых лицензирующему органу
|
Орган, ответственный за предоставление сведений
|
|
1.
|
В отношении соискателя лицензии — идентификационный номер налогоплательщика (ИНН), дата государственной регистрации, местонахождения (почтовый адрес), фирменное наименование, организационно-правовая форма, форма собственности.
|
Регистрирующий орган (Центры государственных услуг)
|
|
2.
|
В отношении заведующего аптекой, заведующего филиалом аптеки, заведующего складом организации оптовой реализации лекарственных средств и изделий медицинского назначения — фамилия, имя, отчество, серия и номер паспорта, дата выдачи паспорта, орган выдавший паспорт, срок действия паспорта.
|
Министерство внутренних дел Республики Узбекистан
|
|
3.
|
В отношении заведующего аптекой, заведующего филиалом аптеки, заведующего складом организации оптовой реализации лекарственных средств и изделий медицинского назначения — идентификационный номер налогоплательщика.
|
Государственный налоговый комитет Республики Узбекистан
|
|
4.
|
В отношении юридического лица-соискателя лицензии — сведения о наличии контрольно-кассовой машины, средств по выдаче товарного чека.
|
|
5.
|
В отношении соискателя лицензии (лицензиата) — сведения об уплаченных сборах, государственных пошлин за рассмотрение заявления, выдачу лицензии на осуществление розничной реализации лекарственных средств и изделий медицинского назначения.
|
Организация-оператор единой биллинговой системы учета сумм государственных пошлин и сборов, уплаченных за оказание государственных услуг.
|
|
6.
|
В отношении здания (помещения) соискателя лицензии — сведения о принадлежности здания соискателю лицензии, праве его пользования и необходимых сведений об эксплуатации помещений, предназначенных для осуществления лицензируемого вида деятельности.
|
Государственный комитет Республики Узбекистан по земельным ресурсам, геодезии, картографии и государственному кадастру.
|
|
7.
|
В отношении заведующего:
аптекой — сведения о наличии высшего фармацевтического образования, дата выдачи диплома и наименование учреждения его выдавшего;
филиалом аптеки — сведения о наличии фармацевтического образования, дата выдачи диплома и наименование учреждения его выдавшего;
складом организации оптовой реализации лекарственных средств и изделий медицинского назначения — сведения о наличии фармацевтического образования, дата выдачи диплома и наименование учреждения его выдавшего
|
Министерство высшего, среднего специального образования Республики Узбекистан
|
|
8.
|
В отношении:
заведующего аптекой, филиалом аптеки — сведения о наличии свидетельства о повышении квалификации, дата выдачи и наименование учреждения его выдавшего;
заведующего складом организации оптовой реализации лекарственных средств и изделий медицинского назначения — сведения о наличии свидетельства о повышении квалификации, дата выдачи и наименование учреждения его выдавшего;
ответственных специалистов в сфере производства и контроля качества — сведения о наличии свидетельства о повышении квалификации, дата выдачи и наименование учреждения его выдавшего.
|
Министерство здравоохранения Республики Узбекистан
|
(приложение № 5 в редакции постановления Кабинета Министров Республики Узбекистан от 22 января 2018 года № 40 — Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
ПРИЛОЖЕНИЕ № 6
к постановлению Кабинета Министров
от 12 мая 2017 года № 284
ПЕРЕЧЕНЬ
некоторых постановлений Кабинета Министров Республики Узбекистан, признаваемых утратившими силу
1. Постановление Кабинета Министров от 13 мая 2010 г. № 91 «О мерах по дальнейшему совершенствованию порядка лицензирования фармацевтической деятельности» (СП Республики Узбекистан, 2010 г., № 5, ст.21).
2. Пункт 40 приложения к постановлению Кабинета Министров от 1 февраля 2012 г. № 26 «О внесении изменений и дополнений в некоторые решения Правительства Республики Узбекистан (Закон Республики Узбекистан от 7 сентября 2011 года № ЗРУ-292 «О внесении изменений и дополнений в Закон Республики Узбекистан «О лицензировании отдельных видов деятельности»)» (СП Республики Узбекистан, 2012 г., № 2, ст. 5).
3. Пункт 103 приложения № 1 к постановлению Кабинета Министров от 1 ноября 2012 г. № 313 «О внесении изменений и дополнений, а также признании утратившими силу некоторых решений Правительства Республики Узбекистан (Указ Президента Республики Узбекистан от 16 июля 2012 года № УП-4453 «О мерах по кардинальному сокращению статистической, налоговой, финансовой отчетности, лицензируемых видов деятельности и разрешительных процедур»)» (СП Республики Узбекистан, 2012 г., № 11, ст. 79).
4. Пункт 34 приложения № 1 к постановлению Кабинета Министров от 17 июля 2014 г. № 196 «О внесении изменений и дополнений, а также признании утратившими силу некоторых решений Правительства Республики Узбекистан (постановление Президента Республики Узбекистан от 15 апреля 2014 г. № ПП-2164 «О мерах по дальнейшему совершенствованию процедур, связанных с осуществлением предпринимательской деятельности и предоставлением государственных услуг»)» (СП Республики Узбекистан, 2014 г., № 7, ст. 73).
(Собрание законодательства Республики Узбекистан, 2017 г., № 20, ст. 364; Национальная база данных законодательства, 23.01.2018 г., № 09/18/40/0609)
Номер документа:
№ 284
Дата принятия:
12.05.2017